Forskning giver nyt designprincip for vandspaltede katalysatorer

En ny undersøgelse viser, at brintatomer er løst bundet og meget mobile på overfladen af en platinkatalysator under vandspaltningsreaktionen. Resultaterne forklarer, hvorfor platin er så god til at katalysere netop denne reaktion, og kunne hjælpe med design af katalysatorer lavet af materialer, der er billigere og mere rigeligt end platin. Kredit:Peterson Lab / Brown University
Forskere har længe vidst, at platin er langt den bedste katalysator til at spalte vandmolekyler for at producere brintgas. En ny undersøgelse foretaget af Brown University-forskere viser, hvorfor platin fungerer så godt - og det er ikke grunden, der er blevet antaget.
Forskningen, udgivet i ACS katalyse , hjælper med at løse et næsten århundrede gammelt forskningsspørgsmål, siger forfatterne. Og det kunne hjælpe med at designe nye katalysatorer til fremstilling af brint, der er billigere og mere rigeligt end platin. Det kan i sidste ende hjælpe med at reducere emissioner fra fossile brændstoffer.
"Hvis vi kan finde ud af, hvordan man laver brint billigt og effektivt, det åbner døren til en masse pragmatiske løsninger til fossilfrie brændstoffer og kemikalier, " sagde Andrew Peterson, en lektor ved Brown's School of Engineering og undersøgelsens seniorforfatter. "Brint kan bruges i brændselsceller, kombineret med overskydende CO2 for at lave brændstof eller kombineret med nitrogen for at lave ammoniakgødning. Der er meget vi kan gøre med brint, men at gøre vandspaltning til en skalerbar brintkilde, vi har brug for en billigere katalysator."
At designe nye katalysatorer starter med at forstå, hvad der gør platin så speciel for denne reaktion, Peterson siger, og det var det, denne nye forskning havde til formål at finde ud af.
Platin's succes er længe blevet tilskrevet dets "Goldilocks" bindingsenergi. Ideelle katalysatorer holder hverken for løst eller for stramt på reagerende molekyler, men et sted i midten. Bind molekylerne for løst, og det er svært at få en reaktion i gang. Bind dem for stramt og molekyler klæber til katalysatorens overflade, gør en reaktion svær at fuldføre. Bindingsenergien af brint på platin tilfældigvis perfekt balancerer de to dele af vandspaltningsreaktionen - og derfor har de fleste videnskabsmænd troet, at det er den egenskab, der gør platin så godt.
Men der var grund til at stille spørgsmålstegn ved, om det billede var korrekt, siger Peterson. For eksempel, et materiale kaldet molybdændisulfid (MoS2) har en bindingsenergi, der ligner platin, er dog en langt værre katalysator for vandspaltningsreaktionen. Det tyder på, at bindingsenergi ikke kan være hele historien, siger Peterson.
For at finde ud af, hvad der skete, han og hans kolleger studerede vandspaltningsreaktionen på platinkatalysatorer ved hjælp af en særlig metode, de udviklede til at simulere individuelle atomers og elektroners adfærd i elektrokemiske reaktioner.
Analysen viste, at de brintatomer, der er bundet til overfladen af platin ved "Goldilocks"-bindingsenergien, faktisk slet ikke deltager i reaktionen, når reaktionshastigheden er høj. I stedet, de putter sig i det krystallinske overfladelag af platin, hvor de forbliver inaktive tilskuere. De brintatomer, der deltager i reaktionen, er langt svagere bundet end den formodede "Goldilocks"-energi. Og i stedet for at putte sig i gitteret, de sidder på toppen af platin atomerne, hvor de frit kan mødes med hinanden for at danne H2-gas.
Det er den bevægelsesfrihed for brintatomer på overfladen, der gør platin så reaktivt, konkluderer forskerne.
"Dette fortæller os, at det ikke er det rigtige designprincip for højaktivitetsområdet at lede efter denne 'Goldilocks' bindende energi. " sagde Peterson. "Vi foreslår, at design af katalysatorer, der sætter brint i denne meget mobile og reaktive tilstand, er vejen at gå."
 Varme artikler
Varme artikler
-
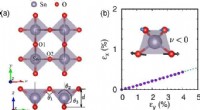 Forskere laver teoretisk forudsigelse af 2-D halvleder tindioxidFig. 1. (a) Atomstrukturen af et 2D δ-SnO2-monolag. (b) Stammen i x -retningen som følge af en påført trækbelastning i y -retningen. Kredit:JIANG Peng For nylig, Prof. 2 ) enkeltlagsfase (P-4
Forskere laver teoretisk forudsigelse af 2-D halvleder tindioxidFig. 1. (a) Atomstrukturen af et 2D δ-SnO2-monolag. (b) Stammen i x -retningen som følge af en påført trækbelastning i y -retningen. Kredit:JIANG Peng For nylig, Prof. 2 ) enkeltlagsfase (P-4 -
 Energiteamet udvikler processer til at øge biobaseret flybrændstofForskere ved University of Delawares Catalysis Center for Energy Innovation - et Energy Frontier Research Center støttet af US Department of Energy - fremmer udviklingen af vedvarende jetbrændstof f
Energiteamet udvikler processer til at øge biobaseret flybrændstofForskere ved University of Delawares Catalysis Center for Energy Innovation - et Energy Frontier Research Center støttet af US Department of Energy - fremmer udviklingen af vedvarende jetbrændstof f -
 Intelligent genvinding og genbrug af balsatræOmkring 20 procent af elektriciteten i Tyskland blev produceret af vindmøller i 2018. Kredit:Hans-Peter Merten/MATOfoto Der er 30, 000 vindmøller i drift i Tyskland, hvoraf mange begynder at ældes
Intelligent genvinding og genbrug af balsatræOmkring 20 procent af elektriciteten i Tyskland blev produceret af vindmøller i 2018. Kredit:Hans-Peter Merten/MATOfoto Der er 30, 000 vindmøller i drift i Tyskland, hvoraf mange begynder at ældes -
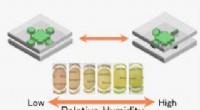 Funktionsfilm lavet af miljøvenlige lermineraler og farvestofferGennemsigtig hybridfilm sammensat af miljøvenlige lermineraler og farvestoffer, der ændrer farve med fugtighed via en ny mekanisme. Kredit:Shinsuke Takagi Forskere fra Tokyo Metropolitan Universit
Funktionsfilm lavet af miljøvenlige lermineraler og farvestofferGennemsigtig hybridfilm sammensat af miljøvenlige lermineraler og farvestoffer, der ændrer farve med fugtighed via en ny mekanisme. Kredit:Shinsuke Takagi Forskere fra Tokyo Metropolitan Universit
- Arktisk metanfrigivelse på grund af issmeltning sker sandsynligvis igen
- Tidligere EPA-rådgivere siger, at agenturets kviksølvforslag er mangelfuldt
- Væskedynamik giver indsigt i naturbrands adfærd
- Når verden omfavner rummet, den 50 år gamle traktat om det ydre rum skal tilpasses
- To sjældne søløveangreb lukker en bugt ned i San Francisco -bugten
- Forskere udvikler et 3D-billede af en interstellar sky, hvor stjerner fødes


