Ny røntgenmetode har dybtgående konsekvenser for udviklingen af livreddende lægemidler
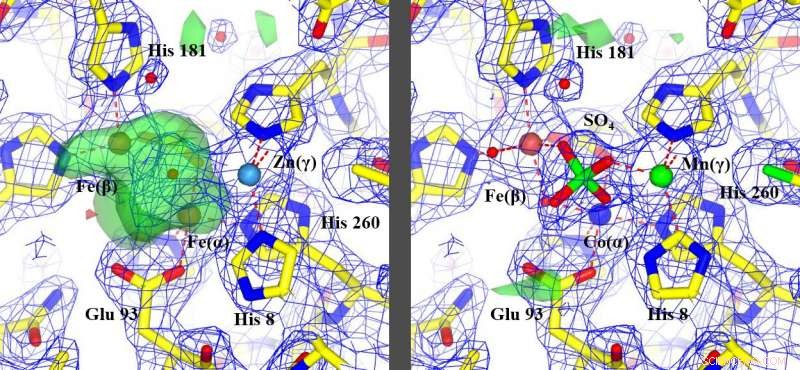
Den nye metode, korrigere de forkert identificerede metaller, tilladt genfortolkning af uidentificerede funktioner, fremhævet med grønt, (billede til venstre) for at identificere, hvordan proteinet virkede, (billedet til højre). Kredit:Edward Snell
Proteiner, der indeholder metal, kendt som metalloproteiner, spiller vigtige roller i biologi, regulering af forskellige veje i kroppen, som ofte bliver mål for livreddende stoffer. Mens mængden af metal i sådanne proteiner normalt er lille, det er afgørende for at bestemme funktionen af disse komplekse molekyler.
Forskere har længe vidst, at metalloproteiner er afgørende for at forstå sygdomme, såsom kræft, og til at udvikle nye lægemidler, da inhibitorer af metalloproteiner er blevet brugt til at behandle sygdomme fra cancer og HIV/AIDS til bakterielle infektioner og hypertension. Men der har ikke været en pålidelig, analytisk metode til at bestemme identiteten og mængden af metalatomer i metalloproteiner.
Nu, i en undersøgelse offentliggjort i sidste måned i Journal of the American Chemical Society , et internationalt hold af forskere rapporterer, at de har udviklet en måde at entydigt identificere og tælle metalatomer i proteiner på en effektiv og rutinemæssig måde. Bruger det, holdet - som omfattede forskere fra universitetet i Buffalo, Hauptman-Woodward Medical Research Institute og andre - afslørede ny information, der var der, men tidligere skjult.
Kaldes partikelinduceret emission af røntgenstråler, eller PIXE, metoden blev først udviklet i 1990'erne af Elspeth F. Garman fra University of Oxford og Geoffrey W. Grime fra University of Surrey Ion Beam Centre, begge forfattere på det aktuelle papir.
Gennembruddet rapporteret i det aktuelle papir er udviklingen af metoden til en effektiv high-throughput tilgang og kombinationen med andre eksperimentelle data for at identificere typen og den nøjagtige position af metallerne i proteinerne. Dette tillader mange forskellige typer proteiner, hvoraf et stort antal udgør livet, som vi kender det, analyseres hurtigt og effektivt, og giver ny information til en bedre strukturel forståelse.
Holdet anvendte den nye metode på 30 tilfældigt udvalgte metalloproteiner, som allerede er i det globale lager af proteinstrukturer kaldet Protein Data Bank. Hvad der derefter skete, chokerede dem.
"Resultatet var fantastisk"
"Jeg sad i Buffalo med min samarbejdspartner fra Oxford, og da vi slog tallene, vi indså begge med det samme, at vi havde gjort en opdagelse, " huskede Edward Snell, Ph.D., en af de tilsvarende forfattere, som er præsident og administrerende direktør for Hauptman-Woodward og professor i Institut for Materiale Design og Innovation, et fælles program for UB's School of Engineering and Applied Sciences og dets College of Arts and Sciences. "Vi forvandlede tallene til et billede, og skjult i dataene var en forklaring på, hvordan denne molekylære maskine fungerede.
"Vi var de første i verden til at se, hvad der havde gemt sig der hele tiden. Resultatet var fantastisk."
Resultaterne viste, at de metoder, der tidligere blev brugt til at bestemme nogle af disse 30 tilfældige proteinstrukturer, enten havde fejlidentificeret metalatomet eller, i nogle tilfælde, savnede det fuldstændig.
"Ifølge vores resultater, den nuværende viden om omkring halvdelen af de prøver, vi undersøgte, er forkert, " sagde Snell.
Forskerne bemærkede, at Protein Data Bank er en kritisk ressource for forskere verden over. I 2017 der var i gennemsnit 1,86 millioner downloads om dagen alene i USA. De bemærker, at et enormt antal forskere bruger strukturer fra databanken uden kendskab til de potentielle grundlæggende fejl, der kan være til stede.
Og pt. mere end 30 % af databankmodellerne indeholder et metal.
Dybtgående implikationer
"Ekstrapolering fra vores resultater, hvor der var et forkert identificeret metal i mindst halvdelen af de undersøgte prøver, tyder på, at over 350, 000 modeller, der downloades om dagen, indeholder muligvis ikke det korrekte metal, " sagde Snell. "Dette har dybtgående konsekvenser for dem, der bruger modellerne. Hvis disse modeller er forkerte, forståelsen af de millioner af mennesker, der bruger dem, bliver mangelfuld."
Snell forklarede, at en af vanskelighederne ved at studere metaller i proteiner er, at de er meget følsomme over for røntgenstråling, så eksperimentet i sig selv kan ændre det, du ser. Men han bemærkede, en teknik, der bruger X-Ray Free Electron Lasers (XFEL'er), forhindrer dette, fordi eksperimenterne normalt er hurtigere end enhver ændring, der kan forekomme.
Snell leder National Science Foundation BioXFEL Science and Technology Center, (Biologi med røntgenfri elektronlasere) et konsortium af UB, Hauptman-Woodward og deres partnere. Centret er dedikeret til at bruge XFEL'er, som producerer utrolig intense røntgenstråler i ekstremt korte pulser, og kan hjælpe med den nøjagtige forståelse af disse metaller i biologiske systemer.
Baseret på hans erfaring med Hauptman-Woodwards high-throughput krystallisationsscreeningscenter, Snell samarbejdede om at implementere PIXE-teknikken i en høj-throughput-indstilling. Han brugte sin viden om røntgenegenskaber til at identificere, at ny strukturel information var til stede i dataene og tog derefter denne viden og forvandlede den til et strukturelt resultat.
"I bund og grund, mine kolleger identificerede metallerne, og vores arbejde i Buffalo viste dem, hvor de skulle placeres, afsløre den nye information, der blev tilgængelig, da metallet i modellen var korrekt, " han sagde.
 Varme artikler
Varme artikler
-
 Forskere udvikler biogummilim til hurtigere kirurgisk bedring og smertelindringFlydende CaproGlu påført kød, der er hærdet med UV-lys, bliver til biogummi. Kredit:Nanyang Technological University Materialeforskere fra Nanyang Technological University, Singapore (NTU Singapor
Forskere udvikler biogummilim til hurtigere kirurgisk bedring og smertelindringFlydende CaproGlu påført kød, der er hærdet med UV-lys, bliver til biogummi. Kredit:Nanyang Technological University Materialeforskere fra Nanyang Technological University, Singapore (NTU Singapor -
 Kontrol af materialekrystallisation ved omrøringSkematisk billede af krystallisation af det kolloide glas. Kredit:Osaka University Overgangen af ustrukturerede amorfe materialer til strukturerede krystallinske materialer induceres generelt ve
Kontrol af materialekrystallisation ved omrøringSkematisk billede af krystallisation af det kolloide glas. Kredit:Osaka University Overgangen af ustrukturerede amorfe materialer til strukturerede krystallinske materialer induceres generelt ve -
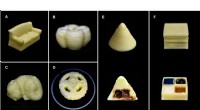 Forskere udvikler en enkel metode til 3-D-print af mælkeprodukterA - D:3D-printede mælkestrukturer af sofa, fæstning, hjul, og kløverblad, henholdsvis. E:3D-printet kegle indeholdende flydende chokoladesirup som internt fyld.F:3D-printet terning med fire rum indeho
Forskere udvikler en enkel metode til 3-D-print af mælkeprodukterA - D:3D-printede mælkestrukturer af sofa, fæstning, hjul, og kløverblad, henholdsvis. E:3D-printet kegle indeholdende flydende chokoladesirup som internt fyld.F:3D-printet terning med fire rum indeho -
 Tværfagligt samarbejde giver sværest, tyndeste belægninger endnu opdagetLehigh University-forskerne Nicholas Strandwitz (til venstre) og Brandon Krick (til højre) mener, at de har opdaget det sværeste, tyndeste, mest slidstærke belægninger endnu - plasma-forstærket atomla
Tværfagligt samarbejde giver sværest, tyndeste belægninger endnu opdagetLehigh University-forskerne Nicholas Strandwitz (til venstre) og Brandon Krick (til højre) mener, at de har opdaget det sværeste, tyndeste, mest slidstærke belægninger endnu - plasma-forstærket atomla
- Folk slipper for overbelastning i byen og leveomkostninger ved at arbejde på afstand
- Så tæt på! SpaceXs Falcon 9 mangler bare at blive ved at lande på droneskib
- Tilsætning af organisk stof til jorden har en begrænset effekt på vandholdende kapacitet
- Sådan Check A /C Kompressor Motor & Startkondensator
- Hvad man skal fodre vilde hjorte
- Flere arbejdere, der arbejder, får muligvis ikke mere arbejde, myrer (og robotter) viser


