Forskerhold finder mulig ny tilgang til sovesygemedicin
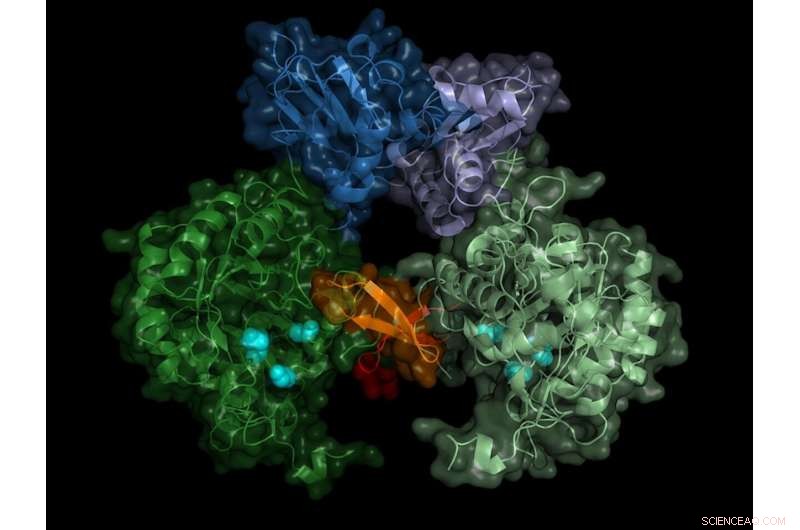
Struktur af parasittens IMP-dehydrogenase. Det aktive enzym danner par (dimerer), "switch"-området (Bateman-regionen) vises i blå nuancer. Kredit:Lübeck Universitet/DESY, Lars Redecke
Ved hjælp af ultra-lyse røntgenblitz, et team af forskere har sporet et potentielt mål for nye lægemidler mod sovesyge:Forskerne har afkodet den detaljerede rumlige struktur af et vigtigt enzym af patogenet, parasitten Trypanosoma brucei. Resultatet giver en mulig plan for et lægemiddel, der specifikt blokerer dette enzym og dermed dræber parasitten, som holdet ledet af Christian Betzel fra universitetet i Hamborg, Lars Redecke fra universitetet i Lübeck og DESY, og Henry Chapman fra DESY rapporterer i tidsskriftet Naturkommunikation .
Sovesyge (afrikansk trypanosomiasis) er en tropisk sygdom forårsaget af parasitten Trypanosoma brucei, som overføres ved bid af tsetse-fluer, der bor i store dele af det tropiske Afrika. I kroppen, parasitten formerer sig først under huden, i blodet og i lymfesystemet og migrerer derefter til centralnervesystemet. Hvis det ikke behandles, sygdommen er næsten altid dødelig. Takket være intensive kontrolforanstaltninger, antallet af registrerede sager er faldet drastisk de seneste år. Alligevel, sovesyge betragtes stadig som en af de mest betydningsfulde tropiske sygdomme. Ifølge Verdenssundhedsorganisationen, mere end 60 millioner mennesker i landdistrikterne i Afrika syd for Sahara er i fare. Krig, forskydning og migration kan få sygdommen til at blusse op.
I jagten på et muligt udgangspunkt for lægemidler mod patogenet, forskerne havde målrettet et centralt enzym i den encellede organisme, inosin-5'-monophosphatdehydrogenase (IMPDH). "Dette enzym hører til den centrale beholdning af enhver organisme og er et interessant mål for lægemidler, fordi det regulerer koncentrationen af to vitale nukleotider i cellen:guanosin-diphosphat og guanosintrifosfat, " siger Redecke. "Cellen har brug for disse nukleotider til at levere energi og til at bygge større strukturer såsom genomet. Hvis du afbryder denne cyklus, cellen dør."
Enzymet har en slags tænd/sluk-knap, der aktiveres ved docking af cellens egne molekyler. En lovende tilgang er at blokere denne switch med et præcist skræddersyet molekyle. For at konstruere en sådan inhibitor, den nøjagtige rumlige struktur af kontakten skal være kendt. Strukturelle biologer kan bestemme strukturen af biomolekyler ved hjælp af røntgenstråler. At gøre dette, de vokser først små krystaller fra biomolekylerne, som derefter genererer karakteristiske diffraktionsmønstre, når de belyses med røntgenstråler. Ud fra disse mønstre krystallens atomare struktur og dens byggesten, biomolekylerne, kan beregnes.
Denne tilgang er ofte kompliceret af de fleste biomolekylers vanskelige evne til at danne krystaller. Og hvis sådanne krystaller kan dyrkes, de er normalt ekstremt følsomme over for de højenergiske røntgenstråler og ødelægges hurtigt. "Selvom strukturerne af adskillige IMP-dehydrogenaser allerede er kendte, der havde ikke været succes med at dyrke krystaller af Trypanosoma brucei-versionen af enzymet, " rapporterer Betzel, som også er forsker i Cluster of Excellence CUI:Advanced Imaging of Matter ved University of Hamburg og DESY.

Sygdommen overføres af tsetsefluen. Kredit:CDC, Kay DeWitt (offentligt domæne)
Holdet valgte derfor en alternativ vej:gruppen af medforfatter Michael Duszenko ved universitetet i Tübingen inducerede visse insektceller til at krystallisere biomolekyler i dem. Ved at bruge denne såkaldte in cellulo krystallisation, det samme hold havde allerede dechifreret et andet nøgleenzym af sovesygepatogenet, cathepsin B, som også er et potentielt lægemiddelmål. Det viste sig, at de ændrede insektceller også producerer krystaller af den nu undersøgte dehydrogenase. Disse krystaller danner små nåle omkring 5 tusindedele af en millimeter (5 mikrometer) tykke og op til 70 mikrometer lange, så de stak ud fra de producerende celler.
Cellulo-krystallerne er så små, at der kræves meget klare røntgenstråler for at analysere dem. Jo større en krystal er, jo flere atomer i det kan sprede røntgenstråler, hvilket forårsager et bedre diffraktionsmønster. Forskerne brugte derfor LCLS-røntgenlaseren på SLAC National Accelerator Laboratory i USA til analysen. "Røntgenlasere genererer ekstremt intense blink, " forklarer Chapman, der er Lead Scientist hos DESY i Center for Free-Electron Laser Science CFEL og en af talsmændene for Cluster of Excellence CUI:Advanced Imaging of Matter. "Selvom de følsomme krystaller fordamper med det samme, de genererer først et diffraktionsmønster, hvorfra strukturen kan opnås." Metoden, der bruges her til at udnytte disse egenskaber, kaldet seriel femtosekund krystallografi, blev udviklet tidligere af mange af de forskere, der er involveret i denne undersøgelse og kåret som et af årets ti bedste gennembrud af magasinet Science i 2013.
Holdet registrerede diffraktionsmønstrene på mere end 22, 000 mikrokrystaller og var i stand til at beregne enzymets rumlige struktur med en nøjagtighed på 0,28 milliontedele millimeter (nanometer) - det svarer nogenlunde til diameteren af et aluminiumsatom. "Resultatet viser ikke kun den nøjagtige struktur af enzymomskifteren, Bateman-regionen, men også hvilke molekyler i cellen der aktiverer switchen, og hvordan disse såkaldte co-faktorer binder sig til enzym switchen, " rapporterer Karol Nass, som udførte dette arbejde under sine ph.d.-studier på DESY. Han arbejder nu på Paul Scherrer Instituttet i Schweiz og er, sammen med Redecke, en hovedforfatter til publikationen.
Omskifteren betjenes af molekylerne adenosintrifosfat (ATP) og guanosinmonofosfat (GMP). "Fordelen ved vores metode er ikke kun, at vi er i stand til at undersøge enzymet ved stuetemperatur, hvor enzymet naturligt virker, men også at under cellulokrystallisation binder de naturlige co-faktorer sig til enzymet, " sagde Betzel. Ifølge forskeren, dataene kan nu give en tilgang til at hæmme parasittens IMP-dehydrogenase. "Man kunne tænke på at konstruere en slags lås, der ville dække bindingsstederne for begge co-faktorer, for eksempel."
Imidlertid, en tilbageværende udfordring er at designe IMP-dehydrogenaseinhibitoren på en så specifik måde, at den blokerer parasittens enzym, men ikke det menneskelige enzym. Hvis dette lykkes, metoden kan potentielt udvides til andre patogener, forklarer Betzel. "Andre parasitter har en meget lignende struktur, og det kan også være muligt at angribe dem via den respektive IMP-dehydrogenase. Enzymet er et meget interessant mål for lægemidler, for eksempel mod rævebåndormen eller elefantiasispatogenet."
Universiteterne i Hamborg, Lübeck og Tübingen, det russiske videnskabsakademi, Arizona State University, Lawrence Livermore National Laboratory i USA, Max Planck Institut for Medicinsk Forskning, US National Accelerator Laboratory SLAC, Göteborgs Universitet og DESY var involveret i denne forskning.
Sidste artikelHurtig test for at påvise salmonella i fødevarer
Næste artikelBæredygtige 3D-printede supermagneter
 Varme artikler
Varme artikler
-
 Brug af en SN1-reaktion til at lave kvartære stereocentreSpejlbillede-selektivitet i substitutionsreaktioner. en, I en SN2-reaktion, en reaktant kaldet en nukleofil (Nu; prikker angiver et ensomt elektronpar) angriber et kulstofatom i et organisk molekyle f
Brug af en SN1-reaktion til at lave kvartære stereocentreSpejlbillede-selektivitet i substitutionsreaktioner. en, I en SN2-reaktion, en reaktant kaldet en nukleofil (Nu; prikker angiver et ensomt elektronpar) angriber et kulstofatom i et organisk molekyle f -
 Team opdager en mekanisme, planter bruger til at slå fotosyntesen tilDenne figur viser proteinet, til højre, som ændres fra energiskaber til energidissipator af ikke-dobbeltlagslipid, venstre. Kredit:Washington State University Høst af sollys for at skabe energi er
Team opdager en mekanisme, planter bruger til at slå fotosyntesen tilDenne figur viser proteinet, til højre, som ændres fra energiskaber til energidissipator af ikke-dobbeltlagslipid, venstre. Kredit:Washington State University Høst af sollys for at skabe energi er -
 Isolerende mursten med mikroskopiske boblerFor at opnå de samme isoleringsværdier som en 165 mm tyk væg af aerobricks, en mur af perlitsten skal være 263 mm tyk — og en mur af ikke-isolerende mursten skal være mere end en meter. Kredit:Empa
Isolerende mursten med mikroskopiske boblerFor at opnå de samme isoleringsværdier som en 165 mm tyk væg af aerobricks, en mur af perlitsten skal være 263 mm tyk — og en mur af ikke-isolerende mursten skal være mere end en meter. Kredit:Empa -
 Sådan beregnes den gennemsnitlige årlige temperaturHvis du har den snigende mistanke om, at det lokale klima har ændret sig de sidste par år, vil beregning af den gennemsnitlige årlige temperatur hjælpe med at fjerne mysteriet. Den gennemsnitlige årli
Sådan beregnes den gennemsnitlige årlige temperaturHvis du har den snigende mistanke om, at det lokale klima har ændret sig de sidste par år, vil beregning af den gennemsnitlige årlige temperatur hjælpe med at fjerne mysteriet. Den gennemsnitlige årli
- Forskere vil følge i månernes slipstream for at fange solpletbilleder i høj opløsning
- Sådan laver du et videnskabsprojekt på fingeraftryk
- Nanoskala spin-bølge kredsløb baseret på konstruerede rekonfigurerbare spin-teksturer
- Atomfilm af smeltende guld kan hjælpe med at designe materialer til fremtidige fusionsreaktorer
- Hvad er nogle abiotiske faktorer i en tempereret regnskov?
- Fordel og ulempe ved kerneenergi


