Brug af en SN1-reaktion til at lave kvartære stereocentre
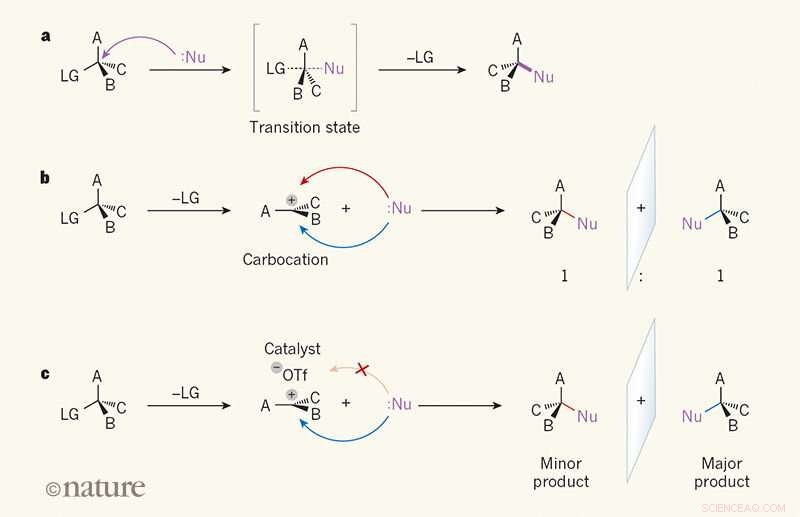
Spejlbillede-selektivitet i substitutionsreaktioner. en, I en SN2-reaktion, en reaktant kaldet en nukleofil (Nu; prikker angiver et ensomt elektronpar) angriber et kulstofatom i et organisk molekyle fra den modsatte side af en 'forlader'-gruppe (LG). EN, B og C kan være et hvilket som helst atom eller gruppe. I overgangstilstanden, bindingen mellem carbonatomet og LG er delvist brudt, og en binding mellem Nu og carbonatomet er delvist dannet (delvis brudte og delvist dannede bindinger er vist som stiplede linjer). Forbindelsen til LG bryder derefter, og et enkelt produkt dannes. b, I SN1-reaktionen, LG udgives først, og en plan, ladet mellemprodukt kaldet en carbocation danner. Fordi Nu kan angribe kulsyren lige så let fra begge sider, produktet dannes som et forhold på 1:1 af spejlbillede isomerer (enantiomerer). c, Wendlandt et al.1 rapporterer en SN1-reaktion, hvor en katalysator med lille molekyle og en triflation (–OTf) binder til den ene side af karbokationen, dirigerer nukleofilen til den anden side. Én enantiomer fremstilles derfor fortrinsvis. Kredit: Natur (2018). DOI:10.1038/s41586-018-0042-1
Et team af forskere ved Harvard University i USA har udviklet en måde, hvorpå vi kan lave en SN1-reaktion for at lave kvartære kulstof-stereocentre. I deres papir offentliggjort i tidsskriftet Natur , holdet beskriver overvindelsen af SN1-reaktioners tendens til at ødelægge stereokemi for at lave det kulstofcentrerede materiale. Tobias Morack og Ryan Gilmour fra universitetet i Münster i Tyskland, tilbyde et nyheder og synspunkter om undersøgelsen i samme tidsskriftsudgave.
Som forskerne bemærker, indtil nu, der har ikke været nogen god metode til at lave kvartære stereocentre. Nuværende metoder, de bemærker, tendens til at være baseret på pro-chirale substrater, som i sig selv er en udfordring at lave. I denne nye indsats, holdet på Harvard kom med en ny tilgang – en baseret på SN1-reaktionen.
SN1-reaktioner er en grundpille i indledende kurser i organisk kemi, men de forårsager notorisk kaos med stereokemi. På trods af det, forskerne troede, at de kunne bruge det flade carbocation-mellemprodukt, der produceres i sådanne reaktioner, som et substrat. Til det formål, de kom frem til en SN1-reaktion, der omdannede en blanding af propargylacetat (med lige store mængder venstre- og højrehåndede enantiomerer - en racemisk) til en blanding med et kvaternært center. En hydrogenbindingsdonor blev brugt som katalysator til at fjerne acetoxymaterialerne, som blev erstattet med en allylblanding - resultatet var en enkelt enantiomer.
Slutprodukterne var interessante, Morack og Gilmour noter, fordi kulstofstereocentrene havde en bred vifte af elektronorbitaler. Det betyder, at de har forskellige fysiske geometrier og dermed reagerer forskelligt. Dette åbner døren for at bruge dem til at producere en bred vifte af molekyler, der kan bruges i forskellige reaktioner til at syntetisere nye kemikalier.
Forskerne bemærker, at de ikke er færdige med arbejdet - de planlægger at prøve den samme tilgang med forbindelser, der ikke er så stabile. Ved at gøre sådan, de erkender, vil kræve brugen af en katalysator, der er endnu mere reaktiv. De planlægger også at se på at udføre reaktionen med forskellige nukleofiler.
© 2018 Phys.org
 Varme artikler
Varme artikler
-
 Ny enhed forenkler måling af fluorforurening i vandEt diagram af SION-105 prototype-enheden:Et hætteglas indeholdende en rød selvlysende suspension af SION-105-krystaller er placeret inde i enheden. Når to dråber vandprøve tilsættes til hætteglasset,
Ny enhed forenkler måling af fluorforurening i vandEt diagram af SION-105 prototype-enheden:Et hætteglas indeholdende en rød selvlysende suspension af SION-105-krystaller er placeret inde i enheden. Når to dråber vandprøve tilsættes til hætteglasset, -
 Ny platform til at skabe og karakterisere materialeblandinger kan fremskynde udviklingen markantYale University ph.d.-studerende Kristof Toth (billedet ovenfor) med det elektrosprayaflejringsværktøj, han designede, bygget, og valideret i samarbejde med stabsforsker Gregory Doerk fra Brookhaven L
Ny platform til at skabe og karakterisere materialeblandinger kan fremskynde udviklingen markantYale University ph.d.-studerende Kristof Toth (billedet ovenfor) med det elektrosprayaflejringsværktøj, han designede, bygget, og valideret i samarbejde med stabsforsker Gregory Doerk fra Brookhaven L -
 Ny kemi til at kontrollere volumen af væske i volumetrisk additiv fremstillingXolography 3D -printteknologi. en, Gengivet illustration af printzonen og tilhørende fotoinducerede reaktionsveje for DCPI. b, Absorbansspektrum for DCPI i harpiks 1 under mørke forhold (grå) og 375 n
Ny kemi til at kontrollere volumen af væske i volumetrisk additiv fremstillingXolography 3D -printteknologi. en, Gengivet illustration af printzonen og tilhørende fotoinducerede reaktionsveje for DCPI. b, Absorbansspektrum for DCPI i harpiks 1 under mørke forhold (grå) og 375 n -
 3-D bioprint af levende strukturer med indbyggede kemiske sensorer3D bioprintet struktur indeholdende grønne alger (Chlamydomonas) i en hydrogel. Kredit:Anja Lode, TU Dresden En ny metode muliggør ikke-invasiv overvågning af iltmetabolisme i celler, der er 3-D b
3-D bioprint af levende strukturer med indbyggede kemiske sensorer3D bioprintet struktur indeholdende grønne alger (Chlamydomonas) i en hydrogel. Kredit:Anja Lode, TU Dresden En ny metode muliggør ikke-invasiv overvågning af iltmetabolisme i celler, der er 3-D b


