Sniger op på små krystaller med elektrondiffraktion
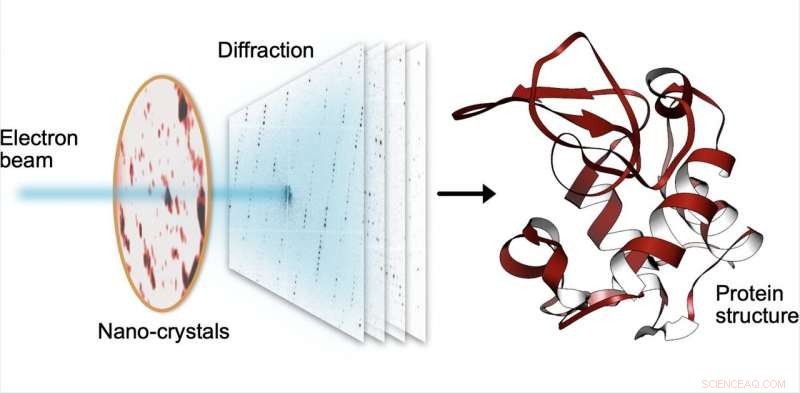
Ved seriel elektrondiffraktion, en lille elektronstråle rammer sekventielt tusindvis af små krystaller lavet af proteiner, som spreder strålen i diffraktionsmønstre. Fra disse mønstre, strukturen af proteinerne kan bestemmes med høj opløsning. Kredit:Robert Bücker
Forståelse af proteiners struktur, livets byggesten, er afgørende for at få indsigt i deres biologiske funktion. På grund af deres lille størrelse og ekstreme skrøbelighed, disse strukturer er enormt svære at bestemme. At indhente data med tilstrækkelig opløsning kræver enorme doser af højenergi røntgenstråling, hvilket desværre uigenkaldeligt skader de proteiner, der primært undersøges.
Nu har forskere fra MPSD og DESY i Hamborg udviklet en opfindsom ny metode, som undgår disse faldgruber og bruger tilgængelige, omkostningseffektiv teknologi. Deres arbejde med at beskrive den nye metode er nu blevet offentliggjort i Naturkommunikation .
I årtier, forskere fra mange områder såsom fysik, biologi, og biokemi har hældt deres kreativitet i at omgå strålingsskade-gåden. Nuværende tilgange omfatter brugen af ekstremt korte og intense røntgenglimt på faciliteter som den nye europæiske røntgenfri elektronlaser (EuXFEL) i Hamborg, som kan tage godt eksponerede billeder af proteiner, før de bogstaveligt talt får dem til at eksplodere.
Selvom denne metode har været spektakulær succesfuld til at opnå højopløsningsproteinstrukturer, generering af røntgenstråler med den nødvendige lysstyrke nødvendiggør brugen af store og dyre partikelacceleratorer. Et yderst effektivt alternativ, som praktiseres intensivt på Center for Structual Systems Biology (CSSB) i Hamborg, for eksempel, er helt at give afkald på røntgenstråler, og brug elektronstråler i stedet, som er skånsommere for de sarte biomolekyler og nemmere at generere.

En slowmotion-film, der samler diffraktionsmønstre (venstre) fra tusindvis af små krystaller (højre) i et elektronmikroskop. Kredit:Robert Bücker
MPSD/DESY forskerholdet ved Center for Free-Electron Laser Science (CFEL) har genialt kombineret sådanne metoder med big data computing og nylige forbedringer inden for kamerateknologi og formået at opnå højopløselige proteinstrukturer fra relativt let tilgængelige nanokrystaller. For at opnå dette, de har udviklet en teknik kaldet seriel elektrondiffraktion ved at tilpasse eksperimentelle metoder, der allerede er kendt i røntgenkrystallografisamfundet til sekventielt at erhverve og behandle diffraktionsmønstre fra tusindvis af krystaller.
I stedet for at implementere et milliard-euro-instrument som EuXFEL, de fordelte simpelthen disse krystaller på en tynd kulstoffilm og indsatte dem i et transmissionselektronmikroskop, en allestedsnærværende enhed. Elektronstrålen er lavet til at hoppe fra den ene nanokrystal til den næste for at opnå diffraktionsdata. Bortset fra materialebesparelser på ofte sjældne og dyre prøver, at bruge nanokrystaller betyder, at forskerne ikke længere behøver at dyrke store proteinkrystaller, som det kræves af ældre (røntgen)metoder - en opgave, der ofte viser sig uoverkommelig vanskelig.
For at omgå skaden forårsaget af elektronstrålen, i stedet for kun at tage et enkelt billede, en kort film optages med et højhastighedskamera, mens elektronstrålen hviler på hver krystal. I filmen, man kan bogstaveligt talt se proteinerne i krystallen "smelte væk" - dog der er nok information i denne diffraktion-under-destruktion-film til at rekonstruere data næsten, som om der ikke var nogen skade overhovedet. Denne procedure gentages for tusindvis af nanokrystaller, og inden for et par timer, ved hjælp af specialiseret software udviklet hos DESY, den enorme mængde data omdannes til en proteinstruktur med høj opløsning.
Ud over proteiner og andre biomolekyler, seriel elektrondiffraktion er også anvendelig til mange klasser af nye funktionelle materialer, såsom perovskitter og metalorganiske rammer - alle lovende kandidater til fremtidige anvendelser i solceller og brintlagring. Forskerholdet er begejstret for brugervenligheden af denne innovative teknik, med dets lave udstyrskrav og brede anvendelighed. De forventer, at det vil sprede sig fra MPSD til laboratorier over hele verden.
Sidste artikelAt forme molekylernes ringe
Næste artikelAt have øje for farver:Printbare lyssensorer
 Varme artikler
Varme artikler
-
 Ny undersøgelse af biofilm kan føre til en mere bæredygtig vandindustriKredit:Pixabay/CC0 Public Domain En lille reduktion af mængden af rester af desinfektionsmiddel, vi bruger til at vedligeholde rent drikkevand, kan give betydelige forbedringer af vandkvaliteten
Ny undersøgelse af biofilm kan føre til en mere bæredygtig vandindustriKredit:Pixabay/CC0 Public Domain En lille reduktion af mængden af rester af desinfektionsmiddel, vi bruger til at vedligeholde rent drikkevand, kan give betydelige forbedringer af vandkvaliteten -
 Studerer mekanismen for metalekstraktion med ioniske væskerOpløsning af ionisk flydende betainium -bis (trifluormethylsulfonyl) imid i den vandige fase starter kemiske interaktioner og fordeling af ioner mellem de to flydende faser. Kredit:J. Mol et al., Virk
Studerer mekanismen for metalekstraktion med ioniske væskerOpløsning af ionisk flydende betainium -bis (trifluormethylsulfonyl) imid i den vandige fase starter kemiske interaktioner og fordeling af ioner mellem de to flydende faser. Kredit:J. Mol et al., Virk -
 Tværfagligt samarbejde giver sværest, tyndeste belægninger endnu opdagetLehigh University-forskerne Nicholas Strandwitz (til venstre) og Brandon Krick (til højre) mener, at de har opdaget det sværeste, tyndeste, mest slidstærke belægninger endnu - plasma-forstærket atomla
Tværfagligt samarbejde giver sværest, tyndeste belægninger endnu opdagetLehigh University-forskerne Nicholas Strandwitz (til venstre) og Brandon Krick (til højre) mener, at de har opdaget det sværeste, tyndeste, mest slidstærke belægninger endnu - plasma-forstærket atomla -
 Grøn produktion af kemikalier til industrienBiokatalysator:to forskellige proteiner samler sig selv i en hydrogel, ligner en to-komponent klæbemiddel. Kredit:Grafik:Theo Peschke, SÆT Industrien bruger store mængder råolie til at producere b
Grøn produktion af kemikalier til industrienBiokatalysator:to forskellige proteiner samler sig selv i en hydrogel, ligner en to-komponent klæbemiddel. Kredit:Grafik:Theo Peschke, SÆT Industrien bruger store mængder råolie til at producere b
- Naturbrand kan udgøre en risiko for reservoirer
- Ved Victoria-søen, en grøn plet breder sig over Afrikas blå hjerte
- Undersøgelse viser, at nogle vandplanter afhænger af landskabet til fotosyntese
- Forbedring af klimaobservationer giver et stort investeringsafkast
- Rekordbrækkende metalens kunne revolutionere optiske teknologier
- Automatiseret system kan omskrive forældede sætninger i Wikipedia-artikler


