Gamle oprindelser af allosterisk aktivering i de ældste kinaser
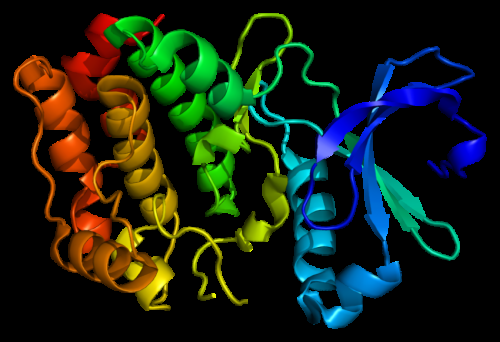
Struktur af Aurora A kinaseproteinet. Baseret på PyMOL molekylær visualiseringssystem gengivelse af Protein Data Bank (PDB) 1mq4. Kredit:Skabt af Emw, Wikimedia CC BY-SA 3.0.
Et af de vigtigste træk i udviklingen af mere komplekse organismer er fremkomsten af allosterisk regulering. Allosteri er en proces, hvorved et proteins aktivitet kan moduleres ved at binde et effektormolekyle distalt til det aktive sted.
På trods af den enorme betydning af allosteri i biologi, spørgsmålet om, hvordan en sådan egenskab udviklede sig, er uudforsket territorium.
I en artikel offentliggjort online den 22. februar i Videnskab , professor i biokemi og Howard Hughes Medical Institutes efterforsker Dorothee Kern og hendes laboratorium adresserer, hvad der uden tvivl er en af de mest fundamentale evolutionære drivkræfter for biologi - allosteri.
Ved at spore den evolutionære vej for moderne proteinkinaser fra deres gamle fælles forfædre for omkring 1,5 milliarder år siden til nutiden, Kern og hendes kolleger opdagede den ældgamle oprindelse af allosterisk regulering for første gang.
For at studere et så grundlæggende spørgsmål, forskerne valgte at genoplive udviklingen af Aurora kinase sammen med dens allosteriske regulator, TPX2. Disse proteiner styrer cellecyklussen hos mennesker og er derfor varme kræftmål.
I avisen, forskerne beregnede først aminosyresekvenserne af disse gamle proteiner ved hjælp af den hidtil største sekvensdatabase og bioinformatik. De lavede derefter disse enzymer i laboratoriet og karakteriserede deres biokemiske egenskaber.
De fandt ud af, at de ældste kinaser (ca. 1,5 milliarder år gamle) allerede bruger autophosphorylering til deres regulering. Dette giver mening ud fra et evolutionært synspunkt, da processen kun behøver sit eget katalytiske maskineri.
Den mere sofistikerede allosteriske regulering, via binding til et andet protein, starter for omkring 1 milliard år siden med forekomsten af den partner, TPX2.
Påfaldende nok, forskerne fandt, at i modsætning til den gængse opfattelse, der er ingen coevolution - gensidige ændringer i begge partnere langs den evolutionære bane - men at hele interfasen af deres interaktion snarere forbliver konstant i 1 milliard år. Med andre ord, de fandt ud af, at co-konservering var en ekstrem stærk evolutionær begrænsning.
Men hvad skete der med allosterisk aktivering? Denne avancerede regulering udvikler sig gradvist over 1 milliard år, hvilket fører til den stærkeste allosteriske aktivering i vores humane kinase. Forskerne opdagede, at dens mekanisme er udviklingen af et sofistikeret allosterisk netværk, der spænder over hele kinasen fra stedet for TPX2-bindingen til den anden side af proteinet.
Kerns fund har vidtrækkende implikationer for forståelsen af kompleksitetsudviklingen fra ekstremt primitive skabninger til den menneskelige art, og for nye tilgange til cancerterapi ved at udnytte de nyopdagede allosteriske netværk i vores moderne proteiner.
 Varme artikler
Varme artikler
-
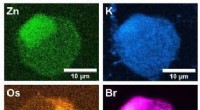 Forskere observerer, hvordan potentiel kræftbehandling reagerer i en enkelt celleRøntgenfluorescensbilleder taget ved I14-strålelinjen ved Diamond Light Source:Det grønne er zink, blå er kalium, orange er osmium og pink er brom. Kredit:University of Warwick Ved hjælp af en 185
Forskere observerer, hvordan potentiel kræftbehandling reagerer i en enkelt celleRøntgenfluorescensbilleder taget ved I14-strålelinjen ved Diamond Light Source:Det grønne er zink, blå er kalium, orange er osmium og pink er brom. Kredit:University of Warwick Ved hjælp af en 185 -
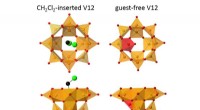 Flipped metaloxidbur kan sortere kuldioxid fra kulilteAnionstrukturer af CH 2 Cl 2 (gæst)-indsat V12 (venstre) og gæstefri V12 er vist. Orange og røde firkantede pyramider repræsenterer VO 5 enheder med deres baser rettet mod midten af skålen, og
Flipped metaloxidbur kan sortere kuldioxid fra kulilteAnionstrukturer af CH 2 Cl 2 (gæst)-indsat V12 (venstre) og gæstefri V12 er vist. Orange og røde firkantede pyramider repræsenterer VO 5 enheder med deres baser rettet mod midten af skålen, og -
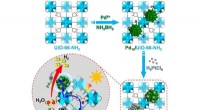 Enkeltatomlegering:Fremragende cokatalysator til fotokatalyseOverfladeladningstilstanden af co-katalysator spiller en vigtig rolle i fotokatalyse. Imidlertid, forordningen om overfladeladningstilstand for co-katalysatorer, især ved at ændre deres mikrostruktu
Enkeltatomlegering:Fremragende cokatalysator til fotokatalyseOverfladeladningstilstanden af co-katalysator spiller en vigtig rolle i fotokatalyse. Imidlertid, forordningen om overfladeladningstilstand for co-katalysatorer, især ved at ændre deres mikrostruktu -
 Kompakt fiberoptisk apparat skinner lys på åndedrætsanalyse i realtidKredit:Tohoku University Ved hjælp af hulkerne optisk fiber som en følsom gascelle, forskere i Japan har udviklet en relativt enkel og overkommelig sensor til overvågning af biomarkører i menneske
Kompakt fiberoptisk apparat skinner lys på åndedrætsanalyse i realtidKredit:Tohoku University Ved hjælp af hulkerne optisk fiber som en følsom gascelle, forskere i Japan har udviklet en relativt enkel og overkommelig sensor til overvågning af biomarkører i menneske
- Forskning giver yderligere indsigt i grafen-baseret elektronik
- Sådan måles gasledninger
- Nyt værktøj registrerer samtidig magnetiske felter i forskellige retninger
- Ingen plads til klimaforsinkelse, FN -chef fortæller online topmøde
- Forældre- og bedsteforældreforhold spiller en vigtig rolle i at opmuntre til altruistiske handling…
- Prisbillig blysensor til hjemmet, byens vandledninger


