Gør rekombinant-protein-lægemidler billigere
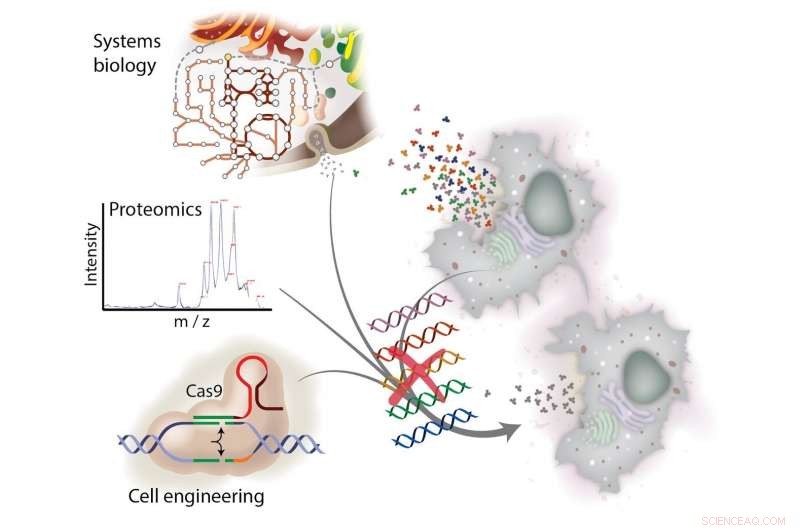
Oprydning af CHO -celler til forbedret lægemiddelproduktion indebærer en tværfaglig forskningstilgang. Ved at rydde op i pattedyrcellelinjer, der producerer rekombinante proteiner, forskere går en vej til renere, billigere lægemidler til behandling af kræft, gigt og andre komplekse sygdomme. Kredit:University of California - San Diego
De pattedyrcellelinjer, der er konstrueret til at producere højværdi rekombinant-protein-lægemidler, producerer også uønskede proteiner, der presser de samlede omkostninger til fremstilling af disse lægemidler op. Disse samme proteiner kan også sænke lægemiddelkvaliteten. I et nyt blad i Naturkommunikation , forskere fra University of California San Diego og Danmarks Tekniske Universitet viste, at deres genomredigeringsteknikker kunne eliminere op til 70 procent af det kontaminerende protein efter masse i rekombinantproteinmedicin produceret af arbejdsheste i pattedyrsceller-kinesisk hamster Ovary ( CHO) celler.
Med holdets CRISPR-Cas-medierede genredigeringstilgang, forskerne påviser et betydeligt fald i oprensningskrav på tværs af de pattedyrcellelinjer, de undersøgte. Dette arbejde kan føre til både lavere produktionsomkostninger og lægemidler af højere kvalitet.
Rekombinante proteiner tegner sig i øjeblikket for størstedelen af de mest solgte lægemidler, herunder lægemidler til behandling af komplekse sygdomme lige fra gigt til kræft og endda bekæmpelse af infektionssygdomme såsom COVID-19 ved at neutralisere antistoffer. Imidlertid, prisen på disse lægemidler sætter dem uden for rækkevidde af en stor del af verdens befolkning. De høje omkostninger skyldes blandt andet, at de produceres i dyrkede celler i laboratoriet. En af de største omkostninger er rensning af disse lægemidler, som kan stå for op til 80 procent af fremstillingsomkostningerne.
I et internationalt samarbejde, forskere ved University of California San Diego og Danmarks Tekniske Universitet har for nylig demonstreret potentialet til at beskytte kvaliteten af rekombinante proteinlægemidler og samtidig øge deres renhed væsentligt før oprensning, som rapporteret i undersøgelsen med titlen "Multiplex secretome engineering forbedrer rekombinant proteinproduktion og renhed" offentliggjort i april 2020 i tidsskriftet Naturkommunikation .
"Celler, såsom kinesisk hamster ovarie (CHO) celler, dyrkes og bruges til at producere mange førende lægemidler, " forklarede Nathan E. Lewis, Lektor i pædiatri og bioingeniør ved University of California San Diego, og meddirektør for CHO Systems Biology Center ved UC San Diego. "Imidlertid, ud over den medicin, vi ønsker, cellerne producerer og udskiller også mindst hundredvis af deres egne proteiner i bouillonen. Problemet er, at nogle af disse proteiner kan forringe kvaliteten af lægemidlerne eller kunne fremkalde negative bivirkninger hos en patient. Det er derfor, der er så strenge regler for oprensning, da vi ønsker den sikreste og mest effektive medicin som muligt."
Disse værtscelleproteiner (HCP'er), der udskilles, fjernes omhyggeligt fra hver batch af lægemiddel, men før de fjernes, de kan forringe stoffernes kvalitet og styrke. De forskellige trin i oprensningen kan fjerne eller yderligere beskadige stofferne.
"Allerede på et tidligt stadium af vores forskningsprogram, vi spekulerede på, hvor mange af disse udskilte kontaminerende værtscelleproteiner kunne fjernes, " fortalte direktør Bjørn Voldborg, Leder af CHO Core-faciliteten ved Center for Biosustainability på Danmarks Tekniske Universitet.
I 2012 tildelte Novo Nordisk Fonden en stor bevilling, som har finansieret banebrydende arbejde inden for genomik, systembiologi og storskala genomredigering til forskning og teknologisk udvikling af CHO-celler ved Center for Biosustainability ved Danmarks Tekniske Universitet (DTU) og University of California San Diego. Dette finansierede de første offentligt tilgængelige genomsekvenser for CHO-celler, og har givet en unik mulighed for at kombinere syntetisk og systembiologi til rationelt at konstruere CHO -celler til biofarmaceutisk produktion.
"Værtscelleproteiner kan være problematiske, hvis de udgør en betydelig metabolisk efterspørgsel, forringe produktkvaliteten, eller opretholdes under hele nedstrømsrensningen, "forklarede Stefan Kol, hovedforfatter på undersøgelsen, der udførte denne forskning, mens han var på DTU. "Vi antog, at med flere runder af CRISPR-Cas-medieret genredigering, vi kunne reducere værtscelleproteinniveauer på en trinvis måde. På dette tidspunkt, vi forventede ikke at få stor indflydelse på HCP-udskillelsen i betragtning af, at der er tusindvis af individuelle HCP'er, der tidligere er blevet identificeret."
Dette arbejde bygger på lovende beregningsarbejde offentliggjort tidligere i 2020.
Forskere ved UC San Diego havde udviklet en beregningsmodel for rekombinant proteinproduktion i CHO-celler, udgivet tidligere i år i Naturkommunikation . Jahir Gutierrez, en tidligere bioingeniør-ph.d. studerende ved UC San Diego brugte denne model til at kvantificere de metaboliske omkostninger ved at producere hvert værtscelleprotein i CHO-sekretomet, og med hjælp fra Austin Chiang, en projektforsker i Department of Pediatrics ved UC San Diego, viste, at et relativt lille antal udskilte proteiner tegner sig for størstedelen af cellens energi og ressourcer. Derfor havde ideen om at eliminere de dominerende forurenende proteiner potentialet til at frigøre en ikke ubetydelig mængde cellulære ressourcer og beskytte lægemiddelkvaliteten. Forfatterne identificerede og fjernede 14 kontaminerende værtscelleproteiner i CHO-celler. Ved at gøre dette eliminerede de op til 70 procent af det forurenende protein i massevis og viste et betydeligt fald i oprensningsbehovet.
Disse modifikationer kan kombineres med yderligere fordelagtige genetiske modifikationer, der identificeres af teamet i et forsøg på at opnå medicin af højere kvalitet til lavere omkostninger.
 Varme artikler
Varme artikler
-
 Bakteriefælde kan hjælpe med at bremse antibiotikaresistensKredit:CC0 Public Domain Forskere har udviklet en ny og hurtigere test til at identificere, hvordan enkelte bakterier reagerer på antibiotika, som kunne hjælpe i kampen mod antimikrobiel resistens
Bakteriefælde kan hjælpe med at bremse antibiotikaresistensKredit:CC0 Public Domain Forskere har udviklet en ny og hurtigere test til at identificere, hvordan enkelte bakterier reagerer på antibiotika, som kunne hjælpe i kampen mod antimikrobiel resistens -
 Knoglebandage opsuger pro-helende biokemiske for at fremskynde reparationenEn ny type knoglebandage fanger naturligt produceret adenosin tæt på bruddet, som fremmer og fremskynder helingen på stedet, før den langsomt frigiver adenosinen tilbage i kroppen. Kredit:Shyni Varghe
Knoglebandage opsuger pro-helende biokemiske for at fremskynde reparationenEn ny type knoglebandage fanger naturligt produceret adenosin tæt på bruddet, som fremmer og fremskynder helingen på stedet, før den langsomt frigiver adenosinen tilbage i kroppen. Kredit:Shyni Varghe -
 Modellering af en bedre katalysator for PIBSA'erKredit:Pixabay/CC0 Public Domain Polyisobutenylravsyreanhydrider (PIBSAer) er vigtige for bilindustrien på grund af deres brede anvendelse i smøremidler og brændstofformuleringer. Deres syntese, i
Modellering af en bedre katalysator for PIBSA'erKredit:Pixabay/CC0 Public Domain Polyisobutenylravsyreanhydrider (PIBSAer) er vigtige for bilindustrien på grund af deres brede anvendelse i smøremidler og brændstofformuleringer. Deres syntese, i -
 Det er ikke vibranium eller proto-adamantium, men forskeres nye legering kommer tæt påKredit:University of North Texas Fire gange stærkere end rustfrit stål, en unik legering blander krom, kobolt, jern, mangan og silicium. Det er ikke Black Panthers vibranium eller Captain America
Det er ikke vibranium eller proto-adamantium, men forskeres nye legering kommer tæt påKredit:University of North Texas Fire gange stærkere end rustfrit stål, en unik legering blander krom, kobolt, jern, mangan og silicium. Det er ikke Black Panthers vibranium eller Captain America


