Opdagelse af bakteriel enzymaktivitet kan føre til nye sukkerbaserede lægemidler
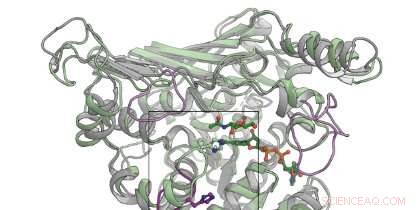
Kredit:Danmarks Tekniske Universitet
Forskere fra DTU Biosustain og DTU Bioengineering har belyst aktiviteten af enzymet N-acetylgalactosaminidase (GH109), hvis aktivitetsmekanisme indtil nu har været et mysterium. Dette enzym kan omdanne en gruppe af lave omkostninger, rigelige såkaldte beta-sukkere til høj værdi, svære at producere alfa-sukker med interessante terapeutiske egenskaber.
Dette nye arbejde om dette enzyms kemi og katalytiske aktivitet åbner muligheder for en bred vifte af anvendelser og er nu blevet offentliggjort i det anerkendte tidsskrift ACS katalyse .
"Vi er meget begejstrede for at have opdaget, hvordan denne menneskelige symbiont bruger hidtil ukendt kemi til at fodre på menneskelige sukkerarter. Nu hvor vi forstår kemien bag denne virkemåde, vi kan ændre enzymet til at lave værdifulde sukkerarter, " siger David Teze, midlertidig gruppeleder for Enzyme Engineering ved Novo Nordisk Foundation Center for Biosustainability (DTU Biosustain) og førsteforfatter til denne publikation.
Bakterie med anti-cancer egenskaber
GH109 findes i den humane tarmbakterie Akkermansia muciniphila, hvor det nedbryder sukkerarter i slim, der findes i tarmen. Når GH109 nedbryder slimens sukkerarter, det gør dem til såkaldte alfa-GalNAc-sukkere, som den lever af.
Bioteknologisk, GH109 kunne tillade tilføjelse af alfa-GalNAc til andre forbindelser. Dette er særligt relevant, da alfa-GalNAc er den "svære at lave" del af et af de mest almindelige cancerantigener, nemlig Thomsen-Friedenreich-antigenet (Galβ1-3GalNAcα1). Dermed, alfa-GalNAc-sukker kan potentielt formuleres til cancervacciner.
"Alpha-GalNAc-holdige sukkerarter kunne være beskyttende mod kræft, men det er svært at syntetisere nok af dem til vacciner. Men nu, vi kan muligvis optimere et enzym til at producere dem bioteknologisk, " siger Teze.
Disse sukkerarter har også sundhedsfremmende egenskaber ved at virke som potente præbiotika (fødevarer til probiotiske bakterier), og andre undersøgelser tyder også på, at de har anti-inflammatoriske egenskaber. Men alfa-GalNAc-sukker er svært at fremstille kemisk. Derfor er biologisk produktion meget interessant og, derfor, funktionen af GH109 bliver meget interessant.
Brug af bioinformatik, mutationsanalyse, strukturelle analyser, beregningsmodellering såvel som krystallografiske undersøgelser - sidstnævnte udføres i et af verdens mest kraftfulde røntgenanlæg, MaxIV, i Lund, Sverige – forskerne afslørede et interessant træk ved GH109. Den aktive side, hvor enzymaktiviteten finder sted, kunne faktisk håndtere to typer inputmolekyler (alfa- og beta-glykaner). Enzymet gør dette ved at have en fleksibel 'arm', der placerer det rigtige input i det aktive sted.
På grund af denne åbenbaring, forskerne har en klarere idé om, hvordan man optimerer dette enzym, åbne en mulighed i stor skala, grøn produktion af α-GalNAcs i fremtiden.
Sidste artikelGelatine kan snart drive vores wearables og IoT-enheder
Næste artikelGennembrud i molekylære maskiner
 Varme artikler
Varme artikler
-
 Forskellen mellem aluminium og dåseMens nogle mennesker henviser til blik dåser og aluminium dåser om hverandre, er de to typer dåser ikke den samme ting. Folk bruger dåse dåser og aluminium dåser til de samme generelle formål; de t
Forskellen mellem aluminium og dåseMens nogle mennesker henviser til blik dåser og aluminium dåser om hverandre, er de to typer dåser ikke den samme ting. Folk bruger dåse dåser og aluminium dåser til de samme generelle formål; de t -
 Ny hydrogel udnytter luftfugtighed til praktiske anvendelserNy vandabsorberende gel opfundet af NUS Engineering-forskere udnytter luftfugtighed til praktiske anvendelser. Kredit:National University of Singapore Høj luftfugtighed giver ubehag og får varme d
Ny hydrogel udnytter luftfugtighed til praktiske anvendelserNy vandabsorberende gel opfundet af NUS Engineering-forskere udnytter luftfugtighed til praktiske anvendelser. Kredit:National University of Singapore Høj luftfugtighed giver ubehag og får varme d -
 Fremtidige biler kan fremstilles af revolutionerende nyt materialeKredit:CC0 Public Domain Et nyt materiale, der er så stift som metal, men fleksibelt nok til at modstå kraftige vibrationer, kan forvandle bilindustrien, siger eksperter fra University of Surrey.
Fremtidige biler kan fremstilles af revolutionerende nyt materialeKredit:CC0 Public Domain Et nyt materiale, der er så stift som metal, men fleksibelt nok til at modstå kraftige vibrationer, kan forvandle bilindustrien, siger eksperter fra University of Surrey. -
 Ny katalysator producerer effektivt brint fra havvandZhifeng Ren, direktør for Texas Center for Superconductivity ved UH og M.D. Anderson Chair Professor i fysik, sagde den nye katalysator giver forskere mulighed for at undgå mange af de forhindringer,
Ny katalysator producerer effektivt brint fra havvandZhifeng Ren, direktør for Texas Center for Superconductivity ved UH og M.D. Anderson Chair Professor i fysik, sagde den nye katalysator giver forskere mulighed for at undgå mange af de forhindringer,
- Hvordan er coroners og medicinske undersøgere forskellige?
- Forskere demonstrerer ny vej til pålidelig kvanteberegning
- Gips som landbrugsprodukt
- Hudplaster kunne smertefrit levere vacciner, kræftmedicin på et minut
- Hvordan påvirker CO2 åbningen af tomater?
- The Mathematikado:En matematik-inspireret parodi på en parodi


