Teknik kunne muliggøre en billigere gødningsproduktion

Et fotografi, der viser en model af en elektrokemisk Haber-Bosch-reaktor koblet til en vandelektrolysator, med reaktorerne fremhævet. Kredit:Massachusetts Institute of Technology
Det meste af verdens gødning produceres i store fabrikker, som kræver enorme mængder energi for at generere de høje temperaturer og tryk, der er nødvendige for at kombinere nitrogen og brint til ammoniak.
MIT kemiingeniører arbejder på at udvikle et alternativ i mindre skala, som de forestiller sig kunne bruges til lokalt at producere gødning til landmænd i fjerntliggende, landdistrikter, såsom Afrika syd for Sahara. Gødning er ofte svær at skaffe i sådanne områder på grund af omkostningerne ved at transportere den fra store produktionsanlæg.
I et skridt hen imod den slags småproduktion, forskerholdet har udtænkt en måde at kombinere brint og nitrogen ved hjælp af elektrisk strøm til at generere en lithiumkatalysator, hvor reaktionen finder sted.
"I fremtiden, hvis vi forestiller os, hvordan vi ønsker, at det skal bruges en dag, vi vil have en enhed, der kan indånde luft, tage vand ind, have et solpanel tilsluttet til det, og kunne producere ammoniak. Dette kunne bruges af en landmand eller et lille samfund af landmænd, " siger Karthish Manthiram, en assisterende professor i kemiteknik ved MIT og seniorforfatter af undersøgelsen.
Kandidatstuderende Nikifar Lazouski er hovedforfatter af papiret, som vises i dag i Naturkatalyse . Andre forfattere omfatter kandidatstuderende Minju Chung og Kindle Williams, og bachelor Michal Gala.
Mindre skala
I mere end 100 år, gødning er blevet fremstillet ved hjælp af Haber-Bosch-processen, som kombinerer atmosfærisk nitrogen med brintgas for at danne ammoniak. Den brintgas, der anvendes til denne proces, er sædvanligvis fremstillet af metan fra naturgas eller andre fossile brændstoffer. Nitrogen er meget ureaktivt, så høje temperaturer (500 grader Celsius) og tryk (200 atmosfærer) kræves for at få det til at reagere med brint og danne ammoniak.
Ved at bruge denne proces, produktionsanlæg kan producere tusindvis af tons ammoniak om dagen, men de er dyre i drift, og de udleder en hel del kuldioxid. Blandt alle kemikalier produceret i store mængder, ammoniak er den største bidragyder til drivhusgasemissioner.
MIT-teamet satte sig for at udvikle en alternativ fremstillingsmetode, der kunne reducere disse emissioner, med den ekstra fordel af decentral produktion. I mange dele af verden, der er lidt infrastruktur til distribution af gødning, gør det dyrt at skaffe gødning i disse regioner.
"Det ideelle kendetegn ved en næste generations metode til fremstilling af ammoniak ville være, at den distribueres. Med andre ord, du kan lave den ammoniak tæt på, hvor du har brug for den, " siger Manthiram. "Og ideelt set, det ville også fjerne CO 2 fodaftryk, der ellers eksisterer."
Mens Haber-Bosch-processen bruger ekstrem varme og tryk til at tvinge nitrogen og brint til at reagere, MIT-holdet besluttede at prøve at bruge elektricitet for at opnå den samme effekt. Tidligere forskning har vist, at anvendelse af elektrisk spænding kan forskyde reaktionens ligevægt, så det begunstiger dannelsen af ammoniak. Imidlertid, det har været svært at gøre dette på en billig og bæredygtig måde, siger forskerne.
De fleste tidligere bestræbelser på at udføre denne reaktion under normale temperaturer og tryk har brugt en lithiumkatalysator til at bryde den stærke tredobbelte binding, der findes i nitrogengasmolekyler. Det resulterende produkt, lithiumnitrid, kan derefter reagere med brintatomer fra et organisk opløsningsmiddel for at producere ammoniak. Imidlertid, det typisk anvendte opløsningsmiddel, tetrahydrofuran, eller THF, er dyrt og forbruges af reaktionen, så det skal løbende udskiftes.
MIT-holdet fandt på en måde at bruge brintgas i stedet for THF som kilden til brintatomer. De designede en mesh-lignende elektrode, der tillader nitrogengas at diffundere gennem den og interagere med brint, som er opløst i ethanol, ved elektrodeoverfladen.
Dette rustfri stål, maskestrukturen er belagt med lithiumkatalysatoren, fremstillet ved at udplade lithiumioner fra opløsning. Nitrogengas diffunderer gennem nettet og omdannes til ammoniak gennem en række reaktionstrin medieret af lithium. Denne opsætning tillader brint og nitrogen at reagere med relativt høje hastigheder, på trods af at de normalt ikke er særlig opløselige i nogen væsker, hvilket gør det mere udfordrende at reagere dem med høje hastigheder.
"Denne klud af rustfrit stål er en måde, hvorpå vi meget effektivt kan bringe nitrogengas i kontakt med vores katalysator, samtidig med at de har de elektriske og ioniske forbindelser, der er nødvendige, " siger Lazouski.
Spaltning af vand
I de fleste af deres ammoniakproducerende eksperimenter, forskerne brugte nitrogen- og brintgasser, der strømmede ind fra en gasflaske. Imidlertid, de viste også, at de kunne bruge vand som brintkilde, ved først at elektrolysere vandet og derefter lede det brint ind i deres elektrokemiske reaktor.
Det samlede system er lille nok til at sidde på en laboratoriebordplade, men det kunne skaleres op til at producere større mængder ammoniak ved at forbinde mange moduler sammen, siger Lazouski. En anden vigtig udfordring vil være at forbedre reaktionens energieffektivitet, som nu kun er omkring 2 procent, sammenlignet med 50 til 80 procent for Haber-Bosch-reaktionen.
"Vi har en overordnet reaktion, der endelig ser positiv ud, hvilket er et stort skridt fremad, " siger han. "Men vi ved, at der stadig er et energitabsproblem, der skal løses. Det vil være en af de vigtigste ting, vi ønsker at tage fat på i det fremtidige arbejde, som vi vil påtage os."
Ud over at fungere som produktionsmetode for små partier gødning, denne tilgang kunne også egne sig til energilagring, siger Manthiram. denne idé, som nu forfølges af nogle videnskabsmænd, opfordrer til at bruge elektricitet produceret af vind- eller solenergi til at drive ammoniakproduktion. Ammoniakken kunne så tjene som flydende brændstof, der ville være relativt let at opbevare og transportere.
"Ammoniak er et så kritisk molekyle, der kan bære mange forskellige hatte, og denne samme metode til ammoniakproduktion kunne bruges i meget forskellige applikationer, " siger Manthiram.
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Materialeforskere lærer at lave flydende krystal-formskiftForskere har også 3D-printet strukturer lavet af to lag LCE med forskellige egenskaber og viste, at dette gav materialet endnu flere grader af frihed til at aktivere. Forskere trykte også gitterstrukt
Materialeforskere lærer at lave flydende krystal-formskiftForskere har også 3D-printet strukturer lavet af to lag LCE med forskellige egenskaber og viste, at dette gav materialet endnu flere grader af frihed til at aktivere. Forskere trykte også gitterstrukt -
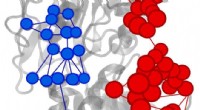 Kemikere finder et nyt værktøj til at forstå enzymer – GoogleEffektorudløst stigning (rød) eller reduktion (blå) af informationsstrømmen i IGPS-enzym. Kredit:Uriel Morzan Yale-forskere har taget en ny tilgang til at optrevle den komplekse struktur og regule
Kemikere finder et nyt værktøj til at forstå enzymer – GoogleEffektorudløst stigning (rød) eller reduktion (blå) af informationsstrømmen i IGPS-enzym. Kredit:Uriel Morzan Yale-forskere har taget en ny tilgang til at optrevle den komplekse struktur og regule -
 Forskere udvikler et lithium-ion-batteri, der ikke bryder i brandKredit:Johns Hopkins University Et fleksibelt lithium-ion-batteri designet af et team af forskere fra Johns Hopkins Applied Physics Laboratory og bygget til at fungere under ekstreme forhold - ink
Forskere udvikler et lithium-ion-batteri, der ikke bryder i brandKredit:Johns Hopkins University Et fleksibelt lithium-ion-batteri designet af et team af forskere fra Johns Hopkins Applied Physics Laboratory og bygget til at fungere under ekstreme forhold - ink -
 Ny metode forenkler søgningen efter proteinreceptorkomplekser, fremskynde lægemiddeludviklingenValerica Raicu, professor i fysik ved University of Wisconsin-Milwaukee, bruger foton -excitationsspektrografi til at hjælpe med at karakterisere proteinreceptorsvar på lægemiddelforbindelser. Kredit:
Ny metode forenkler søgningen efter proteinreceptorkomplekser, fremskynde lægemiddeludviklingenValerica Raicu, professor i fysik ved University of Wisconsin-Milwaukee, bruger foton -excitationsspektrografi til at hjælpe med at karakterisere proteinreceptorsvar på lægemiddelforbindelser. Kredit:
- Tesla-fabrikken kan blive lukket i henhold til californisk sundhedsordre
- FBI opdeler to ulovlige streamingsider med flere abonnenter end Netflix, Amazon Prime og Hulu
- Hvordan man taler med folk om klimaændringer
- Hvad er forskellen mellem 4-D & 3-D?
- Forskere opdager nye former for feldspat
- Hvad sker der, når en dronningbi dør?


