At finde unikke lægemiddelstrukturer med kunstig intelligens og kemi
Kredit:CC0 Public Domain
I jagten på ny medicin mod sygdomme som kræft, et Leiden-team har udviklet en ny arbejdsgang. Denne tilgang kombinerer kunstig intelligens (AI) med molekylær modellering og er velegnet til at finde ukendte og innovative lægemiddelstrukturer, beviste forskerne.
Anti-kræft mål
Med deres nye metode, forskerne fra Leiden Academic Center for Drug Research (LACDR) og Leiden Institute of Advanced Computer Science (LIACS) var i stand til at finde fem stoffer med en hæmmende effekt på en bestemt type kinase. Kinaser er enzymer, der tænder eller slukker andre proteiner og spiller en vigtig rolle i udviklingen af kræft. I deres offentliggørelse i Journal of Chemical Information and Modeling , holdet så på såkaldt polyfarmakologi - lægemiddeludvikling, hvor der er flere mål i kroppen (se boks nedenfor).
Udfordringen
Det startede i december 2017 med en udfordring, siger førsteforfatter og ph.d. kandidat Lindsey Burggraaff. "En non-profit organisation ledet af amerikanske universiteter og adskillige medicinalvirksomheder organiserer jævnligt udfordringer, herunder denne Multi-targeting Drug DREAM Challenge. "Deltagerne blev instrueret i at finde molekyler, der binder til flere kinaser." Der er allerede fundet stoffer, der er aktive på flere kinaser, men de ligner alle meget, " siger Burggraaff. "Derfor ville vi finde nye og originale hits. Disse hits tjener derefter som udgangspunkt for yderligere lægemiddelforskning, som en skabelon, du kan optimere."
En ny strategi
Fordi teamet ønskede at finde nye og originale molekyler i en begrænset periode, de skulle også komme med en ny strategi. Burggraaff:"Generelt, folk vælger enten maskinlæring eller beregningskemi i deres søgen efter medicin. Vi argumenterer nu for, at i tilfælde af polyfarmakologi er det bedst at kombinere de to, især hvis du vil finde nye strukturer på kort tid."
Træning af computeren
Dette fungerer som følger:Burggraaff og hendes afdeling gav LIACS -forskerne et øvelsessæt, som indeholdt kendte molekyler og deres egenskaber. Brug af maskinlæring, computerforskerne var i stand til at træne deres computermodel på en sådan måde, at den kun hentede de aktive molekyler fra sættet. Til udfordringen, de anvendte derefter den samme model på en database med mere end ti millioner stoffer. "Dette resulterede i en kvart million potentielt aktive molekyler. Et effektivt første filter, "siger ph.d. -kandidaten.
Nøgle og lås
Derefter begyndte LACDR's farmakologer at arbejde med strukturbaseret forskning. "Dette involverer simulering af strukturen af dit mål på computeren, I dette tilfælde, kinaseenzymer, " siger Burggraaff. "Computeren beregner, om det molekyle, der testes, passer ind i målet, som en nøgle i en lås. Denne metode er meget mere detaljeret end maskinlæring, men tager også meget mere tid. Derfor fungerer kombinationen så godt."
Ultimativt, deres indsats gav fem molekyler, der viste aktivitet i laboratorietest. "Bevis på, at vores nye måde at arbejde på kan være nyttig. Forresten, det er ikke begrænset til kinaseforskning, det kan også anvendes bredt til andre mål."
Samarbejdet med LIACS stimulerede etableringen af Center for Computational Life Sciences (CCLS) – en klynge af omkring fyrre forskere, herunder forskere fra Institute of Biology Leiden (IBL), det matematiske institut (MI), Leiden Institute of Chemistry (LIC) og Leiden University Medical Center (LUMC). "Vi taler regelmæssigt til forskerne fra computervidenskabsafdelingen, så det var sådan samarbejdet om dette papir startede, "siger Burggraaff. Hun kalder det et vellykket samarbejde." Vi havde kun tre måneder til denne udfordring, og meget arbejde. Så vi har virkelig presset hinanden, " siger Burggraaff.
"CCLS er et vellykket eksempel på, hvordan de forskellige klassiske discipliner vokser tættere sammen på forkant med datalogi, " siger Gerard van Westen, sidste forfatter. "Med SAILS -programmet, vi kombinerer på samme måde ekspertisen fra alle fakulteter inden for kunstig intelligens, men derefter på hele universitetets niveau. Du kan se, at der er lignende udfordringer på meget forskellige områder, som vi kan løse sammen. "I fremtiden vil Burggraaff og Van Westen forventer, at projekter som dette, hvor forskellige videnskabsmænds ekspertise bruges til et konkret formål, vil føre til ny indsigt og innovative lægemidler.
 Varme artikler
Varme artikler
-
 Naturlignende belægning gør batterier mere holdbare og effektiveCarbon nanorør belagt med en belægning ved anvendelse af kuldioxid i molekylær lagdeponering. Kredit:Aalto University Når batterier oplades og bruges, et komplekst SEI (fast elektrolytinterfase) l
Naturlignende belægning gør batterier mere holdbare og effektiveCarbon nanorør belagt med en belægning ved anvendelse af kuldioxid i molekylær lagdeponering. Kredit:Aalto University Når batterier oplades og bruges, et komplekst SEI (fast elektrolytinterfase) l -
 Hvad er et kalorimeter og hvad er dets begrænsninger?Kemikere har ofte brug for at vide, hvor meget varmeenergi en bestemt reaktion frigiver eller absorberer. Denne måling hjælper dem med at forstå mere om, hvorfor reaktionen finder sted, og hjælper
Hvad er et kalorimeter og hvad er dets begrænsninger?Kemikere har ofte brug for at vide, hvor meget varmeenergi en bestemt reaktion frigiver eller absorberer. Denne måling hjælper dem med at forstå mere om, hvorfor reaktionen finder sted, og hjælper -
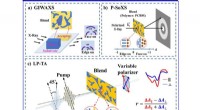 Undersøgelse af molekylær orientering ved polarisationsselektiv forbigående absorptionsspektrosko…Skematisk diagram over (a) GIWAXS, (b) P-SoXS og (c) LP-TA. Kredit:©Science China Press Den organiske solcelle (OSC) heterojunction -grænseflade er, hvor centrale fotofysiske processer som ladning
Undersøgelse af molekylær orientering ved polarisationsselektiv forbigående absorptionsspektrosko…Skematisk diagram over (a) GIWAXS, (b) P-SoXS og (c) LP-TA. Kredit:©Science China Press Den organiske solcelle (OSC) heterojunction -grænseflade er, hvor centrale fotofysiske processer som ladning -
 Det biologisk nedbrydelige batteri, der er 3D-printet, engangs og lavet af papirDet biologisk nedbrydelige batteri består af fire lag, alle flyder ud af en 3D-printer efter hinanden. Det hele bliver så foldet sammen som en sandwich, med elektrolytten i midten. Billede:Gian Vaitl
Det biologisk nedbrydelige batteri, der er 3D-printet, engangs og lavet af papirDet biologisk nedbrydelige batteri består af fire lag, alle flyder ud af en 3D-printer efter hinanden. Det hele bliver så foldet sammen som en sandwich, med elektrolytten i midten. Billede:Gian Vaitl
- Selvsamling af stærkt porøse krystallinske partikler til nye fotoniske materialer til registrering…
- Amazon infiltrerede eBays e-mail-system for at finde topsælgere i global konspiration:Retssag
- Ceranoxid -nanopartikler kan forbedre hepatocellulært carcinomprognose
- PNW skove vil være mindre sårbare over for tørke, ild end Rocky Mountain, Sierra skove
- Vejledninger til at øge effektiviteten af organiske solceller
- Ny undersøgelse giver kort, ice favorability index for virksomheder, der ønsker at mine månen


