Topologikontrol af humane fibroblastceller monolag ved flydende krystal elastomer
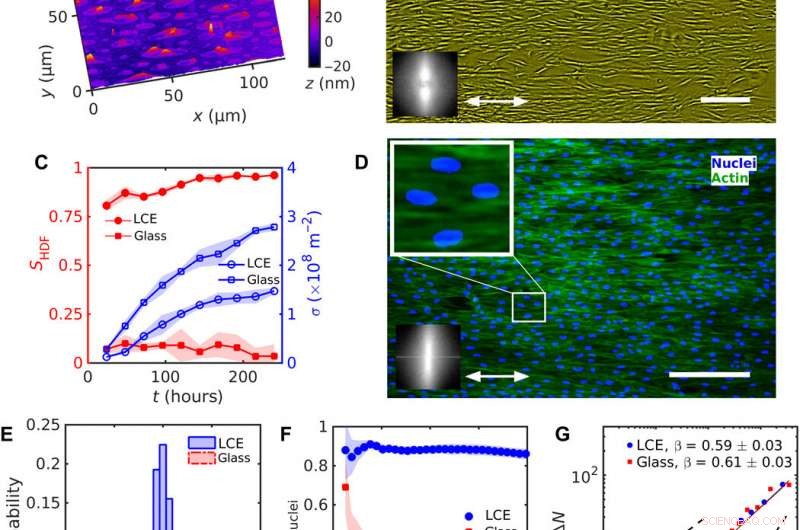
Ensartet justering af HDF-celler på LCE med en ensartet nˆLCE=konst. (A) Digital holografisk mikroskopi (DHM) tekstur af LCE-overfladen efter kontakt med det vandige vækstmedium. (B) Fasekontrast-mikroskopi (PCM) tekstur af HDF-celler, der vokser på LCE-substrater 120 timer efter podning. Dobbelthovedet pil repræsenterer nˆLCE. (C) Udvikling af rækkefølgeparameteren SHDF af cellelegemer (udfyldte røde symboler) og celletæthed σ (tomme blå symboler). (D) Fluorescerende mikroskopiske teksturer af HDF-celler på LCE; fluorescensmærkede kerner (blå) og cytoskelet F-actin proteiner (grøn). Forstørret tekstur viser aflange kerner orienteret i samme retning som cellernes kroppe. Indsætninger i (B) og (D) viser hurtig Fourier-transformation af (B) PCM og (D) fluorescerende F-actin-teksturer, hvilket indikerer orienteringsrækkefølge langs den ensartede nˆLCE. (E) Fordeling af kerneorientering. (F) Afhængighed af rækkefølgeparameteren Snuclei af kerner af størrelsen af et firkantet undervindue. (G) Antal tæthedsudsving ΔN beregnet for det gennemsnitlige antal cellekerner 〈N〉. Skala barer, 300 μm. Kredit:Science Advances, doi:10.1126/sciadv.aaz6485
Eukaryote celler i levende væv kan påvirke vigtige fysiologiske processer såsom apoptose og cellemigration baseret på dynamisk mønsterdannelse med rumligt varierende orienteringer. Imidlertid, det er stadig udfordrende at projicere et foruddesignet kort over orienteringsorden på et voksende væv i laboratoriet. I en ny undersøgelse, der nu er offentliggjort på Videnskabens fremskridt , Taras Turiv og et forskerhold i kemisk fysik, avancerede materialer og biomedicinske videnskaber ved Kent State University, Ohio, OS., detaljerede en ny tilgang til fremstilling af cellemonolag af humane dermale fibroblaster. De prædesignede orienteringsmønstrene og topologiske defekter ved hjælp af en fotojusteret flydende krystal elastomer (LCE), der kvældede anisotropisk i et vandigt medium. Holdet indskrev mønstrene i LCE, og vævsmonolaget replikerede mønstrene for at forårsage stærke variationer i cellefænotyper (størrelse og form), deres overfladetæthed og taltæthedsudsving. Den nye tilgang kan kontrollere den kollektive adfærd af celler i levende væv under celledifferentiering og vævsmorfogenese til brede anvendelser inden for bioteknik og regenerativ medicin.
Celler, der udgør levende væv, udviser ofte orienteringsorden, når de er i tæt kontakt på grund af gensidig justering af anisometriske celler. Retningen af den gennemsnitlige orientering kan variere i rum og tid for at frembringe topologiske defekter kendt som disklinationer. Sådanne defekter kan bevæge sig inde i vævet for at spille en vigtig rolle under kompressions-dilatative belastninger og processer, herunder udvinding af døde celler. Evnen til at designe et vævsstillads af levende celler med orienterende orden og kontrol er vigtig for biomedicinske forskere for at undersøge og manipulere levende stof. Forskere har allerede produceret bestilte cellesamlinger på litografisk fremstillede overflader, inklusive kanterne af mikrokanaler, i mikroriller og overflader med materialestivhedsgradienter. I dette arbejde, Turiv et al. designet væv med en høj grad af orienteringsorden og forudbestemt rumligt varierende retning, baseret på en skabelon af direktørmønstre på LCE-substrater. Holdet brugte humane dermale fibroblastceller (HDF) som byggeenheder i skabelonvævet.
Materialekorn fungerer som en styreskinne for HDF-celler. Kredit:Science Advances, doi:10.1126/sciadv.aaz6485
Fibroblaster er de mest almindelige pattedyrs bindevævsceller, og de bevarer normalt en flad aflang form med vigtige roller under vævsreparation og omstrukturering, samt sårheling. Forskere kan omprogrammere disse celler til pluripotente stamceller til lovende anvendelser inden for diagnostik og terapi. I dette arbejde, de kombinerede virkninger af cellesåning og deling af mønstrede HDF-væv på prædesignede LCE-substrater producerede sammenflydende væv. Den strukturerede LCE havde en markant indvirkning på vævet, hvor de kontrollerede tilpasningsmønsteret og den rumlige fordeling af celler, deres tæthed, udsving, og fænotype. Den mønstrede LCE viste placeringer af topologiske defekter i væv gennem anisotrope overfladeinteraktioner på forudbestemte steder. Da den cellulære justering og topologiske defekter kan kontrollere biokemiske processer på mikroskala, dette arbejde åbner muligheden for at konstruere overflader til kontrolleret vævsmønster for at designe dem til specifikke funktioner.
Under forsøgene, Turiv et al. understøttede LCE-substratet af en glasplade og dækkede det med indiumtinoxid (ITO) for at reducere overfladens ruhed, efterfulgt af coating af et lag af lysfølsomt azofarvestof og dækkede til sidst substratet med et vandigt medium af cellekultur. Overfladekornene på materialet fungerede som en styreskinne for HDF-celler. Når HDF-cellerne blev suspenderet i cellekultur, de så runde ud, men efter at de havde sat sig i underlaget, de udviklede et aflangt udseende. Forskerne registrerede sammenløb (vækst) resultater fra kombinerede virkninger af cellesåning. Resultaterne viste, at orienteringsrækkefølgen opstod på grund af direkte interaktioner mellem celler og LCE-substratet. Substraterne hjalp med at justere både kroppe og kerner af HDF-celler som en vigtig egenskab for mange cellefunktioner, herunder proteinekspression, motilitet, stofskifte og differentiering.

Mønstret justering af HDF-celler på LCE med en (−1/2, +1/2) par defekter. (A) PolScope-tekstur, der viser nˆLCE og optisk retardering af LCE i kontakt med cellevækstmediet. (B og C) DHM-teksturer af LCE-overflade i kontakt med cellevækstmediet med (B) -1/2 og (C) +1/2 defekter. (D) Fluorescensfarvede HDF-celler; 4′, 6-diamidino-2-phenylindol-mærkede cellekerner (blå) og phalloidin-mærkede actin-cytoskeletfilamenter (grøn). (E) Overfladedensiteten af cellekerner σ som funktionen af afstanden r fra +1/2 (blå) og -1/2 (rød) defekte kerner. (F) Store taltæthedsudsving ΔN af kernerne i nærheden af defekte kerner. (G) PCM-billeder af HDF-celler på LCE-substrat 240 timer efter podningen. Blå og røde prikker angiver placeringen af +1/2 og -1/2 defekte kerner, henholdsvis, opnået fra polariseret optisk mikroskopi (POM) tekstur af LCE. (H) Farvekodet orienteringsfelt og (I) det tilsvarende skema for mønstret HDF-vævsdirektør n HDF afbildet med PCM. Røde søjler i (I) angiver lokal orientering af cellernes lange akser. (J) Adskillelse mellem halvstyrkedefekter for vandret og lodret rettet mellem dem (se fig. S6). Skala barer, 300 μm. Kredit:Science Advances, doi:10.1126/sciadv.aaz6485
HDF-cellerne på LCE organiserede sig selv i tilpassede samlinger efter forudbestemte anvisninger. Holdet bemærkede, at cellernes opførsel og celletæthed varierede, når de nærmede sig defektkerner og andre topologiske uoverensstemmelser (defekter af bøjet type eller defekter af sprøjtetype) på LCE-substraterne. Substraterne påvirkede markant HDF-cellerne, der var i kontakt med hinanden, resulting in collectively strong differences in the size and shape of cells. The marked differences indicated the influence of the predesigned patterns on the HDF cell phenotype (size and shape). Based on additional results, Turiv et al. credited the number density fluctuations in tissues to be influenced by the surface charge of director patterns and studied the issue in detail in a larger surface area.
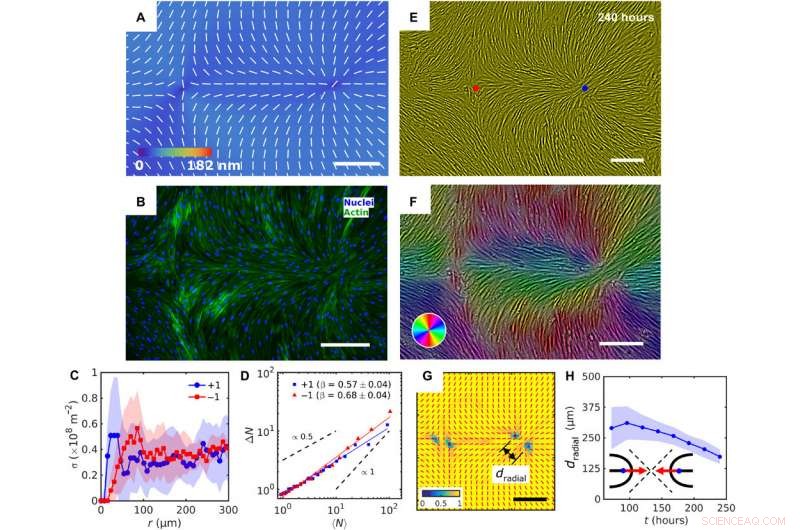
Patterned alignment of HDF cells on LCE predesigned with a pair of −1 and radial +1 (splay type) defects. (A) PolScope image of nˆLCE pattern of LCE in contact with the cell growth medium. (B) Fluorescently labeled HDF cells. (C) The surface density of cell nuclei σ as the function of distance from defect cores. (D) Large number density fluctuations ΔN with mean number of nuclei 〈N〉 showing a larger slope near −1 cores as compared to +1. (E) PCM textures of HDF cells on LCE layer at 240 hours after cell seeding. Red and blue dots denote location of −1 and +1 defects in patterned LCE obtained from crossed polarized textures. (F) Color-coded orientational field and (G) of the corresponding scheme of patterned HDF tissue director nˆHDF obtained from local anisotropy of PCM texture in (E). Red bars in (G) denote local orientation of cells’ long axes. (H) Time dependence of separation between two +1/2 defects near the +1 radial core. Skala barer, 300 μm. Kredit:Science Advances, doi:10.1126/sciadv.aaz6485
På denne måde Taras Turiv and colleagues showed the dynamics and propagation of defects in patterned tissues and how they could be halted through surface anchoring forces. The scientists used LCE substrates with photopatterned structures of varying molecular orientations to grow biological tissues with predesigned cell alignment. The substrates affected cell alignment as well as cell surface density and cell phenotypes. The team noted higher density of cells in defect cores with positive topological charge, while cell density was lower near negative defects. The cells mechanistically aligned to the substrates by swelling upon contact with the aqueous cell culture medium, followed by aligning to predesigned photopatterned direction. This approach will allow materials scientists and bioengineers to design biological tissues with predetermined cell alignment and precise location of orientational defects. The outcomes can facilitate controlled cell migration, differentiation. and apoptosis. The work can be further optimized to advance the understanding of fundamental mechanisms underlying tissue development and regeneration.

The orientational order of the assemblies in +1/2 and −1/2 disclinations. Kredit:Science Advances, doi:10.1126/sciadv.aaz6485
© 2020 Science X Network
 Varme artikler
Varme artikler
-
 Katalysatorfremføring fjerner forurenende stoffer ved lave temperaturerYong Wang, Voiland Distinguished Professor, Gene og Linda Voiland School of Chemical Engineering and Bioengineering. Kredit:WSU Forskere ved Washington State University, University of New Mexico,
Katalysatorfremføring fjerner forurenende stoffer ved lave temperaturerYong Wang, Voiland Distinguished Professor, Gene og Linda Voiland School of Chemical Engineering and Bioengineering. Kredit:WSU Forskere ved Washington State University, University of New Mexico, -
 Kemisk kompleks kan øge udskillelsen af radioaktivt strontium fra kroppenDer er en hypotese om, at M-InsP6 kunne forbedre elimineringen af radiostrontium. M-InsP6 kan binde radiostrontium, hæmmer absorption, og øge udskillelsen. Kredit:Kanazawa University 90 Sr (t1
Kemisk kompleks kan øge udskillelsen af radioaktivt strontium fra kroppenDer er en hypotese om, at M-InsP6 kunne forbedre elimineringen af radiostrontium. M-InsP6 kan binde radiostrontium, hæmmer absorption, og øge udskillelsen. Kredit:Kanazawa University 90 Sr (t1 -
 Effektiv, stabilt termoelektrisk modul baseret på højtydende væskelignende materialerKredit:CC0 Public Domain Baseret på højtydende væskelignende materialer, videnskabsmænd fra Shanghai Institute of Ceramics ved det kinesiske videnskabsakademi og Northwestern University i USA frem
Effektiv, stabilt termoelektrisk modul baseret på højtydende væskelignende materialerKredit:CC0 Public Domain Baseret på højtydende væskelignende materialer, videnskabsmænd fra Shanghai Institute of Ceramics ved det kinesiske videnskabsakademi og Northwestern University i USA frem -
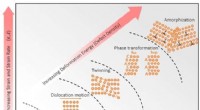 Øer uden struktur inde i metallegeringer kan føre til hårdere materialerForeslået hierarkisk deformationsmekanisme-paradigme for de ækviatomiske CrCoNi-baserede HEAer udsat for stigende grader af deformation. Elastisk deformation, dislokationsmedieret plasticitet, twinnin
Øer uden struktur inde i metallegeringer kan føre til hårdere materialerForeslået hierarkisk deformationsmekanisme-paradigme for de ækviatomiske CrCoNi-baserede HEAer udsat for stigende grader af deformation. Elastisk deformation, dislokationsmedieret plasticitet, twinnin
- Gamle kulturer elskede deres hunde også
- Konceptet med kunstige blade inspirerer til forskning i solcelledrevet brændstofproduktion
- Hvad kan jeg gøre ved global opvarmning?
- Undersøgelse:uden USA, international klimaaftale kunne nås med ændringer
- Byer er nødt til at innovere for at forbedre transport og reducere emissioner
- Hurtigt virkende, farveskiftende molekylær sonde registrerer, når et materiale er ved at svigte


