Se dopaminreceptorer i deres oprindelige levested
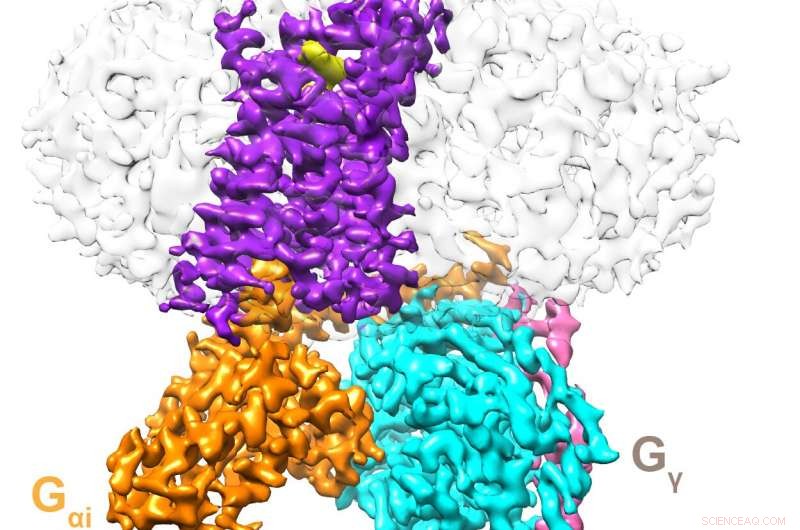
Cryo-EM struktur af D2 dopaminreceptoren bundet til dets G-protein. Kredit:UT Southwestern Medical Center
Dopamin, et kemikalie, der sender beskeder mellem forskellige dele af hjernen og kroppen, spiller en nøglerolle i en række sygdomme og adfærd ved at interagere med receptorer på celler. Men på trods af deres betydning i fysiologi og patologi, strukturen af disse receptorer indlejret i en phospholipidmembran - deres naturlige miljø på celleoverfladen - var ukendt. En ny undersøgelse ledet af UT sydvestlige forskere afslører strukturen af den aktive form af en type dopaminreceptor, kendt som D2, indlejret i en phospholipidmembran.
Disse skelsættende fund, udgivet i dag i Natur , kunne have konsekvenser for grundforskning og for design af lægemidler til behandling af tilstande, hvor D2 -receptoren spiller en grundlæggende rolle, herunder Parkinsons sygdom, psykose, og afhængighed.
Studieleder Daniel Rosenbaum, Ph.d., lektor i biofysik og biokemi ved UT Southwestern Medical Center, forklarer, at kun en tidligere undersøgelse havde belyst strukturen af D2 -receptoren. Den forskning, udgivet i 2018, undersøgte denne struktur i sin inaktive form, bundet til et lægemiddel, der ofte bruges til behandling af skizofreni og andre psykiske og humørsvingninger. Det brugte en teknik kendt som røntgenkrystallografi til at bestemme den overordnede struktur og detergentmolekyler til at rense receptoren som et individuelt molekyle. Imidlertid, tidligere undersøgelser har vist, at når D2-receptorer er gjort opløselige i vaskemiddel og efterladt som frit svævende konstruktioner, deres evne til at binde målmolekyler såsom dopamin og deres analoger er kompromitteret, fører til potentielle unøjagtigheder i strukturen.
For at undgå denne ulempe og se nærmere på D2 -receptoren, Rosenbaum og hans kolleger genetisk manipulerede en form for receptoren, der var betydeligt mere stabil end den native form. Derefter, efter at have produceret disse receptorer i celler, de tillod nogle at binde en forbindelse kaldet bromocriptin, et lægemiddel, der aktiverer D2 -receptorer og bruges til at behandle en række tilstande, herunder Parkinsons sygdom, hypofyse tumorer, og hyperprolaktinæmi. Efter rensning af disse aktiverede receptorer i vaskemiddel, de indlejrede dem i små pletter af phospholipidmembran, et miljø, der ligner deres oprindelige i cellemembraner. De undersøgte derefter D2-receptoren ved hjælp af kryo-elektronmikroskopi, en teknik, der bruger elektronstråler leveret ved meget kolde temperaturer til at dechiffrere molekylers og materialers strukturer i atomskalaen.
Deres resultater viste lignende træk til andre receptorer i samme klasse, en familie af proteiner kendt som G-proteinkoblede receptorer. Ligesom andre lignende receptorer, D2 -receptoren slanger gennem phospholipidmembranen, udsætte domæner for hver side af membranen. Imidlertid, det viste også vigtige forskelle, såsom dele begravet i membranens indre folder, bestilte sidekæder af aminosyrer i membranens grænsefladeområder, og lipidforankring af proteinet, receptoren er koblet til inden i membranen. Binding af bromocriptin ændrede en del af receptoren for at rumme dette molekyle, væsentligt ændrer dens udformning.
Rosenbaum bemærker, at fremtidige undersøgelser vil være nødvendige for at sammenligne og kontrastere disse fund med andre typer dopaminreceptorer for bedre at forstå deres fællestræk og forskelle. Sammen, han siger, disse fund kan være en enorm hjælp i lægemiddeldesign, hvor udvikling af molekyler, der præcist passer til en slags receptor, kan maksimere terapeutiske virkninger og samtidig undgå bivirkninger. Specielt designede lægemidler kan forbedre nuværende terapier betydeligt for de mange forskellige tilstande, hvor dopamin spiller en rolle, herunder kognitiv dysfunktion, multipel sclerose, Parkinsons sygdom, stofmisbrug, psykose, og opmærksomhedsunderskud.
"Dette er bare den første struktur af en aktiveret dopaminreceptor, "siger Rosenbaum, "men det kan tjene som en ramme til at designe og tilpasse nye klasser af forbindelser, der kan ændre aktiviteten af disse typer af receptorer."
 Varme artikler
Varme artikler
-
 Brug af et kraftigt affaldsprodukt:Mod forbedring af køretøjets brændstoføkonomiFint kulfibernetværk fremstillet under optimerede forhold (fra venstre til højre:elektrospundne fibre, termisk stabiliserede fibre kulfiber). Kredit:Kanazawa University I betragtning af bekymringe
Brug af et kraftigt affaldsprodukt:Mod forbedring af køretøjets brændstoføkonomiFint kulfibernetværk fremstillet under optimerede forhold (fra venstre til højre:elektrospundne fibre, termisk stabiliserede fibre kulfiber). Kredit:Kanazawa University I betragtning af bekymringe -
 Grønt materiale til køling identificeretKredit:CC0 Public Domain Forskere fra Storbritannien og Spanien har identificeret et miljøvenligt fast stof, der kan erstatte de ineffektive og forurenende gasser, der bruges i de fleste køleskabe
Grønt materiale til køling identificeretKredit:CC0 Public Domain Forskere fra Storbritannien og Spanien har identificeret et miljøvenligt fast stof, der kan erstatte de ineffektive og forurenende gasser, der bruges i de fleste køleskabe -
 Nyt magnetdesign med spejllignende egenskaberDen magiske spejllignende magnet. Lysstyrken af det transmitterede lys fra magneten ændrer sig alt efter om materialet ses forfra eller bagfra. Kredit:Kouji Taniguchi Forskere ved Tohoku Univers
Nyt magnetdesign med spejllignende egenskaberDen magiske spejllignende magnet. Lysstyrken af det transmitterede lys fra magneten ændrer sig alt efter om materialet ses forfra eller bagfra. Kredit:Kouji Taniguchi Forskere ved Tohoku Univers -
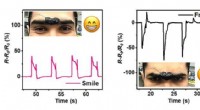 Elektronisk hud strakt til nye grænserSignaler fra den elektrisk ledende hydrogel kan tydeligt skelne mellem forskellige ansigtsudtryk. Kredit:2018 KAUST En elektrisk ledende hydrogel, der kræver strækbarhed, selvhelbredende og belast
Elektronisk hud strakt til nye grænserSignaler fra den elektrisk ledende hydrogel kan tydeligt skelne mellem forskellige ansigtsudtryk. Kredit:2018 KAUST En elektrisk ledende hydrogel, der kræver strækbarhed, selvhelbredende og belast
- Luften over Antarktis bliver pludselig varmere
- Billig, energieffektiv og ren reaktion til fremstilling af kemisk råmateriale
- At studere abstrakte matematiske ligninger ved hjælp af håndgribelige overflader
- Forskere finder beviser for, at spinvæsker i ferromagneter kan ligne dipolvæsker i ferroelektriske…
- Semantisk cache til AI-aktiveret billedanalyse
- Sådan beregnes temperaturusikkerhed


