Forskere får indsigt i, hvordan enzymer opnår specifikke reaktioner
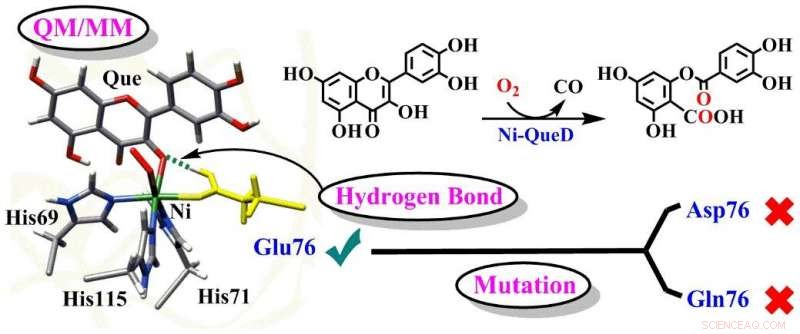
Skematisk illustration af de afgørende roller af Glu76-rest i Ni-QueD. Kredit:Prof. LIs gruppe
Katalytisk dioxygenaktivering og selektiv oxidativ spaltning af C-C-bindinger er blevet forsknings-hotspots inden for kemi på grund af deres store anvendelsesværdi i organisk syntese og industriel produktion.
Quercetin 2, 4-dioxygenaser (QueDs), som et typisk biologisk metalloenzymsystem, kan effektivt aktivere dioxygen og selektivt katalysere C-C-bindings oxidativ spaltning af organiske flavonolsubstrater under milde forhold. Selvom undersøgelser af QueD'er er blevet udført i årtier, de detaljerede katalytiske mekanismer af QueDs, især rollerne af Glu76-resten på det aktive sted, er stadig under debat.
I en undersøgelse offentliggjort i Journal of Catalysis , en gruppe ledet af prof. LI Chunsen fra Fujian Institute of Research on the Structure of Matter (FJIRSM) fra det kinesiske videnskabsakademi rapporterede de detaljerede mekanismer for reaktioner katalyseret af vildtype nikkelafhængigt quercetin 2, 4-dioxygenase (Ni-QueD) og dens Glu76Asp og Glu76Gln mutanter ved at bruge kombinerede MD-simuleringer og QM/MM-beregninger, og de afslørede den kritiske rolle af Glu76-rest i styringen af reaktiviteten af Ni-QueD.
Forskerne fandt ud af, at den konserverede nikkel-ligerende Glu76-rest i den deprotonerede form er afgørende for at starte den katalytiske reaktion ved protonkoblet elektronoverførselsproces.
Den genererede og protonerede Glu76 fremmer den efterfølgende reaktion ved at regulere hydrogenbinding (H-binding) interaktion med carbonylgrupperne i quercetin.
Undersøgelser af Glu76Gln og Glu76Asp mutanter viser, at mutation af Glu76 undertrykker en sådan H-bindingsinteraktion og resulterer i den lavere katalytiske aktivitet observeret eksperimentelt.
Denne undersøgelse giver ikke kun nyttig information om mekanismerne for reaktioner katalyseret af metalion-afhængige QueD'er, men også indsigt i, hvordan enzymer opnår specifikke reaktioner ved at bruge H-bindingsinteraktionen fra metalcenterligerende rester.
 Varme artikler
Varme artikler
-
 Historien bag uendeligt genanvendeligt plastikBerkeley Lab-forskerne Brett Helms (til venstre) og Corinne Scown holder prøver af PDK-plastik, et unikt nyt materiale, der kan genbruges i det uendelige - en stor forbedring i forhold til traditionel
Historien bag uendeligt genanvendeligt plastikBerkeley Lab-forskerne Brett Helms (til venstre) og Corinne Scown holder prøver af PDK-plastik, et unikt nyt materiale, der kan genbruges i det uendelige - en stor forbedring i forhold til traditionel -
 Mikrofluidisk chip kan reducere bivirkninger ved strålebehandlingMikrovaskulaturen (blodkar -systemer i organer) dannet inde i chippen. Kredit:Joe Vittorio Organ-on-a-chip teknologi bruges til at udvikle 3D-modeller, der gør det muligt for forskere i det sydlig
Mikrofluidisk chip kan reducere bivirkninger ved strålebehandlingMikrovaskulaturen (blodkar -systemer i organer) dannet inde i chippen. Kredit:Joe Vittorio Organ-on-a-chip teknologi bruges til at udvikle 3D-modeller, der gør det muligt for forskere i det sydlig -
 Hvad kan påvirke diffusionshastigheden af en molekyle gennem en membran?Diffusion forekommer, når tilfældig molekylær bevægelse får molekyler til at bevæge sig og blandes sammen. Denne tilfældige bevægelse drives af den varmeenergi, der findes i det omgivende miljø. Di
Hvad kan påvirke diffusionshastigheden af en molekyle gennem en membran?Diffusion forekommer, når tilfældig molekylær bevægelse får molekyler til at bevæge sig og blandes sammen. Denne tilfældige bevægelse drives af den varmeenergi, der findes i det omgivende miljø. Di -
 Hvordan trænger peptider ind i celler? To sider af samme møntElektronmikroskopibillede af en todelt cellemembran og det tilsvarende molekylære skema for processen. Kredit:@ IOCB Prag Den simple transport af lægemidler direkte ind i cellerne er et af de prim
Hvordan trænger peptider ind i celler? To sider af samme møntElektronmikroskopibillede af en todelt cellemembran og det tilsvarende molekylære skema for processen. Kredit:@ IOCB Prag Den simple transport af lægemidler direkte ind i cellerne er et af de prim
- Byparker løfter stemningen lige så meget som jul, Twitter -undersøgelse viser
- Kunne vi genoplive dinosaurer fra fossile embryoner?
- Gendannelse af skove 1 træ ad gangen, at hjælpe med at reparere klimaet
- Apple og Samsung afgør langvarig iPhone -patentkamp
- Flere lande udgiver økosystemkonti, overvejer miljø i økonomiske beslutninger
- Nye SOFIA-observationer hjælper med at opklare mysterier om fødslen af kolossale sole


