S-glutathionylering af human-inducerbar Hsp70 afslører reguleringsmekanisme, der involverer C-terminal α-spiralformet låg
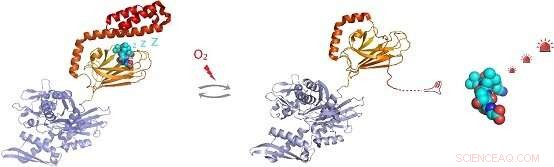
Figur:Under oxidative stressforhold, den molekylære chaperon Hsp70 undergår post-translationel modifikation af cysteinrester ved tilsætning af tripeptidet glutathion. Glutathionylering inden for det substratbindende domæne i Hsp70 får den C-terminale spiralformede region i Hsp70 til at opløses og indtage sit eget substratbindingssted. Dette forhindrer binding, muliggør aktivering af signalmolekylsubstrater såsom varmechoktranskriptionsfaktor Hsf1. Kredit:Dr. Sarah Perretts gruppe
Heat shock protein 70 (Hsp70) proteiner er en familie af ældgamle og konserverede molekylære chaperoner. De spiller en væsentlig rolle i opretholdelsen af proteinhomeostase, herunder lette proteinfoldning og nedbrydning, forhindrer proteinaggregation, og deltager i stressreaktionen. Afbrydelse af det cellulære kvalitetskontrolmaskineri er forbundet med aldring, kræft og neurodegenerative sygdomme.
Post-translationelle modifikationers (PTM'ers) rolle i reguleringen af funktionerne i Hsp70 er et voksende forskningsområde. Selvom oxidativt stress kan være skadeligt, redox -variation er et naturligt træk ved mobilmiljøet og letter signaltransduktion for vigtige fysiologiske aktiviteter. Cystein -modifikationer af proteiner udgør de vigtigste midler til redox -signaloverførsel. Glutathionylering er en reversibel ændring af cysteinrester i proteiner, som kan beskytte proteiner mod irreversibel oxidation, og kan også spille en rolle i signaltransduktion.
I dette studie, glutathionylering af forskellige Hsp70 -familiemedlemmer blev påvist i HeLa -celler, og modifikationsstederne blev konstateret ved massespektrometri af forskere fra prof. Sarah Perrett og prof. Chen Changs gruppe ved Institute of Biophysics ved det kinesiske videnskabsakademi.
Fokus på stress inducerbar Hsp70 HspA1A (hHsp70), den detaljerede strukturelle mekanisme for, hvordan glutathionylering påvirker proteinaktivitet og protein-protein-interaktioner blev undersøgt.
In vivo -påvisning viste, at hver af de fem cysteinrester af hHsp70 kan undergå glutathionylering. In vitro-eksperimenter afslørede, at modifikation af cystein i nukleotidbindingsdomænet i hHsp70 forhindres ved nukleotidbinding, men den Cys-574 og Cys-603, placeret i det C-terminale α-spiralformede låg i det substratbindende domæne, kan undergå glutathionylering i både tilstedeværelse og fravær af nukleotid.
Ved at løse NMR -strukturen af den glutathionylerede form af hHsp70 SBD, det strukturelle grundlag for de funktionelle ændringer blev demonstreret. Glutathionylering af disse cysteinrester resulterer i udfoldelse af a-spiralformet lågstruktur. Den udfoldede region efterligner substrat ved at binde til og blokere substratbindingsstedet, derved fremme iboende ATPase -aktivitet, og konkurrerer med binding af eksterne substrater. Dette fører til en reduktion i dets evne til at binde andre substratproteiner, såsom varmechokfaktoren Hsf1.
Disse resultater indikerer ikke kun, at cysteinmodifikation kan ændre strukturen og funktionen af hHsp70, men også at hHsp70 kan overføre redox -oplysninger til sine klienter.
Denne undersøgelse blev offentliggjort i Journal of Biological Chemistry den 12. juni 2020.
 Varme artikler
Varme artikler
-
 Kemisk blæksprutte fanger luskede kræftspor, spor glykoproteinerDelene, der er formet som en hexagon-pentagon combo, er benzoboroxoler, som gør store glykoproteinfangere, og de er syet sammen for at danne meget fleksible arme med lang rækkevidde. I midten er en ma
Kemisk blæksprutte fanger luskede kræftspor, spor glykoproteinerDelene, der er formet som en hexagon-pentagon combo, er benzoboroxoler, som gør store glykoproteinfangere, og de er syet sammen for at danne meget fleksible arme med lang rækkevidde. I midten er en ma -
 Hvordan selenforbindelser kan blive katalysatorerPatrick Wonner og Stefan Huber har overført princippet om hydrogenbindingen til andre grundstoffer. Kredit:RUB, Marquard Kemikere ved Ruhr-Universität Bochum har testet en ny tilgang til aktiverin
Hvordan selenforbindelser kan blive katalysatorerPatrick Wonner og Stefan Huber har overført princippet om hydrogenbindingen til andre grundstoffer. Kredit:RUB, Marquard Kemikere ved Ruhr-Universität Bochum har testet en ny tilgang til aktiverin -
 Genomminedrift afslører ny produktionsvej til lovende malariabehandlingElizabeth Parkinson, venstre, Lektor i kemi, Purdue University med G. William Arends Professor i molekylær og cellulær biologi William Metcalf, ret. Kredit:University of Illinois at Urbana-Champaign
Genomminedrift afslører ny produktionsvej til lovende malariabehandlingElizabeth Parkinson, venstre, Lektor i kemi, Purdue University med G. William Arends Professor i molekylær og cellulær biologi William Metcalf, ret. Kredit:University of Illinois at Urbana-Champaign -
 Skjult symmetri fundet i kemiske kinetiske ligningerEn kunstners repræsentation af et landskab med fri energi og to mulige veje, et protein kan følge (venstre) for at folde korrekt og en tredje vej (til højre), der fører til en fejlfoldet tilstand. Kre
Skjult symmetri fundet i kemiske kinetiske ligningerEn kunstners repræsentation af et landskab med fri energi og to mulige veje, et protein kan følge (venstre) for at folde korrekt og en tredje vej (til højre), der fører til en fejlfoldet tilstand. Kre


