Forståelse af iltreducerende enzymer

Billeder af F420H2-oxidasekrystaller opnået aerobt med en typisk størrelse på 0,1 mm. Med ilt giver Fe og flavin inde i enzymet den naturlige gule farve til krystallerne. Kredit:Max Planck Institute for Marine Microbiology/T. Wagner
Metan er en stærk drivhusgas, der spiller en central rolle i det globale kulstofkredsløb. På samme tid, det er en vigtig energikilde for os mennesker. Omkring halvdelen af dens årlige produktion er lavet af mikroorganismer kendt som methanogener, der nedbryder organisk materiale såsom døde planter. Dette foregår normalt i et habitat uden ilt, da denne gas er dødelig for methanogener. Men selv i faktisk iltfrie levesteder, iltmolekyler dukker af og til op. For at uskadeliggøre disse ubudne gæster, methanogener har et særligt enzym, der er i stand til at omdanne ilt til vand.
"Enzymer er vitale komponenter i metabolismen af alle levende organismer, og målet med vores laboratorium er at forstå, hvordan disse nanomaskiner fungerer på molekylært niveau, " siger Tristan Wagner fra Max Planck Institute for Marine Microbiology og førsteforfatter af undersøgelsen, offentliggjort i det videnskabelige tidsskrift Kemisk kommunikation i september 2020. Til undersøgelsen, Wagner dyrkede anaerob mikroorganisme kaldet Methanothermococus thermolithotrophicus, som stammede fra sedimentet i Napolibugten. Han rensede enzymet F420-oxidase, et flavodiiron protein, og krystalliserede det, en almindelig metode til at studere enzymers funktion.
"Det var allerede kendt, at F420-oxidase kan omdanne ilt til vand, " siger Wagner. "Men det lykkedes os at dekryptere mekanismen." Undersøgelsen er et samarbejde mellem forskere fra Max Planck Institute for Marine Microbiology, Max Planck Institute for Terrestrial Microbiology, Paul Scherrer Instituttet, det tværfaglige forskningsinstitut i Grenoble og European Synchrotron Radiation Facility.
Ilt er låst inde
Mekanismen, forskerne afslørede, har et vigtigt krav:Ilt er meget reaktivt, så det er afgørende, at reaktionen styres korrekt af enzymet, og ingen opløsningsmidler flyder rundt. Ellers kan ilten ved et uheld blive omdannet til superoxid og dræbe den anaerobe. Tricket med enzymet F420-oxidase er at bruge en gaskanal og et gatingsystem. Oxygenmolekylet ledes først i den specifikke kanal til et passende vandfrit katalytisk hulrum indeholdende jern. Derefter omdanner jern ilten i vand, der frigives af en portmekanisme. For at hulrummet begynder at bevæge sig og åbner en lille "dør". Takket være bevægelsen, det nyproducerede vand transporteres udenfor. Det tomme hulrum lukker igen og er tilgængeligt for det næste iltmolekyle.
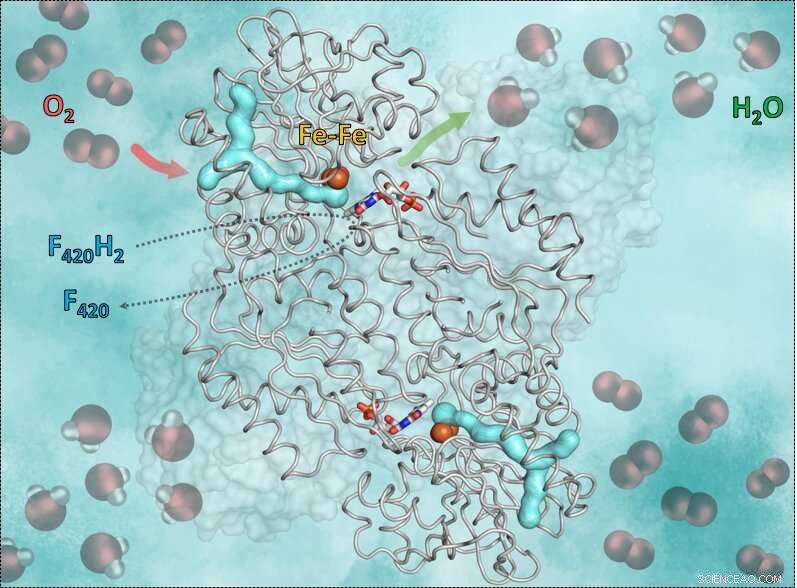
Denne grafik viser enzymet F420H2-Oxidase og den måde, det virker på. Den cyan y-formede del er gaskanalen. Den røde pil viser iltens vej ind til det katalytiske hulrum, der indeholder jern. Den grønne pil symboliserer vejen ud af vandet. Endnu, de blå-røde pinde i midten viser flavin (FMN) accepterende elektroner fra det reducerede coenzym F420, som bringer den nødvendige brint til at omdanne ilten til vand. Kredit:S. Engilberge og T. Wagner
For at få indsigt i denne mekanisme brugte forskerne røntgenkrystallografi. De opnåede først krystalstrukturen uden ilt, hvor de kunne se det vandfri katalytiske hulrum isoleret fra opløsningsmidlet. Derefter, de gassede enzymkrystallerne med den inerte gas krypton, hvilken, i modsætning til ilt, kan gøres synlig ved røntgenstråler. Bagefter bestrålede de enzymkrystallerne og var i stand til at detektere kryptonatomer, der viste gaskanalen, der fører til det katalytiske hulrum. Flavodiiron-proteinet og dets kanal er ikke kun konserveret i methanogener, men også i andre mikroorganismer som clostridia (der hovedsageligt lever i jord eller i fordøjelseskanalen), hos svovlbakterien Desulfovibrio gigas eller endda hos tarmparasitten Giardia intestinalis.
Jo hurtigere jo bedre
"Denne reaktion er virkelig hurtig, " siger Sylvain Engilberge fra Paul Scherrer Institute og førsteforfatter af undersøgelsen ved siden af Tristan Wagner. "Denne hastighed er også den store betydning af vores undersøgelse." Lignende enzymer som laccase er meget langsommere. "Til fremtidig anvendelse af bio-inspireret elektrokemisk processer, vi skal lære mere af den kemiske reaktion, struktur og funktion af forskellige grupper af oxygen-reducerende enzymer, " siger Engilberge. Det ville også bane vejen for proteinteknologi at omdanne en højhastigheds O2-afgiftningsmiddel til en elektrondræn til industrielle processer.
"Vores næste skridt ville være at forstå mangfoldigheden af flavodiiron-protein, " siger Tristan Wagner. Nogle homologer er ikke rettet mod ilt, men det giftige nitrogenoxid, deres enzymer kan skelne mellem begge gasser med høj specificitet. Men hvad er det selektive filter? Gaskanalen? Miljøet i det katalytiske hulrum? "Flere undersøgelser skal udføres for at forstå, hvordan proteinet skelner mellem oxygen og nitrogenoxid, " tilføjer Wagner. Med sådan viden, det ville for eksempel være muligt ud fra genomisk information at forudsige, om et flavodiiron-protein ville være et oxygen- eller nitrogenoxidopfanger.
 Varme artikler
Varme artikler
-
 Overbygningens rolle i førstegangsspændingstab i lithium-ion-batterierFigur 1. Den typiske konfiguration af et RIXS-eksperiment. Indkommende røntgenstråler med høj energiopløsning skinner på prøverne, og de spredte røntgenstråler opløses i energi og bliver opsamlet af e
Overbygningens rolle i førstegangsspændingstab i lithium-ion-batterierFigur 1. Den typiske konfiguration af et RIXS-eksperiment. Indkommende røntgenstråler med høj energiopløsning skinner på prøverne, og de spredte røntgenstråler opløses i energi og bliver opsamlet af e -
 Nye opdagelser og indsigt i glasovergangenDSC spor af La(Ce)NiAl systemet, pilene angiver den kalorimetriske glasovergangstemperatur (Tg) (til venstre). Temperaturafhængigheden af tabsmodulet for La (Ce) NiAl -systemet normaliseret med den
Nye opdagelser og indsigt i glasovergangenDSC spor af La(Ce)NiAl systemet, pilene angiver den kalorimetriske glasovergangstemperatur (Tg) (til venstre). Temperaturafhængigheden af tabsmodulet for La (Ce) NiAl -systemet normaliseret med den -
 Porøse materialer kaster lys over miljørensningFigur 1. Skematisk fremstilling af porøse rammer konstrueret af brintmolekyler. Rammerne skal være stabile, selv efter fjernelse af opløsningsmiddelmolekyler fra porerne. Kredit:Osaka University I
Porøse materialer kaster lys over miljørensningFigur 1. Skematisk fremstilling af porøse rammer konstrueret af brintmolekyler. Rammerne skal være stabile, selv efter fjernelse af opløsningsmiddelmolekyler fra porerne. Kredit:Osaka University I -
 Ingrediens i indisk lang peber viser løfte mod hjernekræft i dyremodellerKredit:Perelman School of Medicine ved University of Pennsylvania Piperlongumine, en kemisk forbindelse fundet i den indiske lange peberplante (Piper longum), er kendt for at dræbe kræftceller i m
Ingrediens i indisk lang peber viser løfte mod hjernekræft i dyremodellerKredit:Perelman School of Medicine ved University of Pennsylvania Piperlongumine, en kemisk forbindelse fundet i den indiske lange peberplante (Piper longum), er kendt for at dræbe kræftceller i m
- Opdateret Apple-system tager på smartphone-afhængighed
- Røntgenstråler og gravitationsbølger kombineres for at belyse massiv sort hulkollision
- Gammelt vinmålebord gravet frem i Jerusalem
- Big data -hype har ikke ført til håndgribelige resultater inden for samfundsvidenskab, siger ekspe…
- Hvordan puster havpæle?
- En gylden kugle til kræft:Nanopartikler giver en målrettet version af fototermisk behandling mod k…


