Forskere opdager de første enzymer til at katalysere en klassisk organisk reaktion
Kredit:University of California, Los Angeles
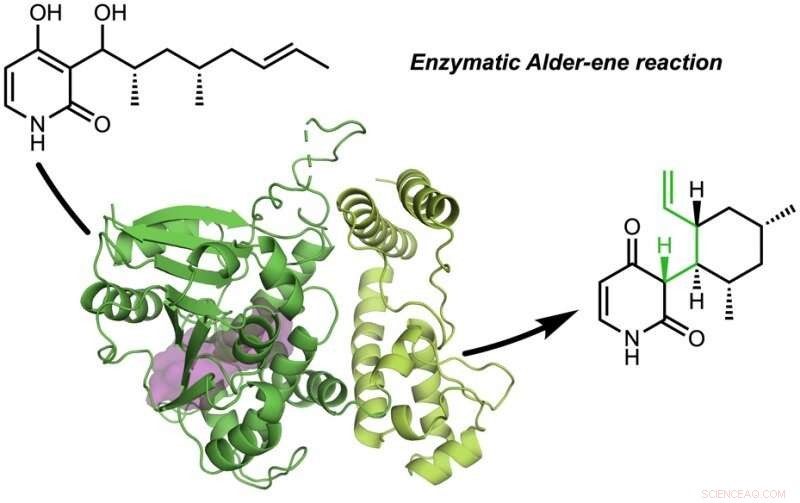
The Tang, Garg, og Houk-forskningsgrupper har opdaget naturens naturlige proteinkatalysatorer (enzymer), der katalyserer Alder-en-reaktionen.
Alle grupper er en del af UCLA Department of Chemistry &Biochemistry. Professor Yi Tang er kanslerprofessor ved UCLA Department of Chemical and Biomolecular Engineering og har også en fælles ansættelse i Institut for Bioteknik. Professor Ken Houk har Saul Winstein Distinguished Research Chair i organisk kemi og professor Neil Garg har Kenneth N. Trueblood Endowed Chair i kemi og biokemi og fungerer som afdelingsformand.
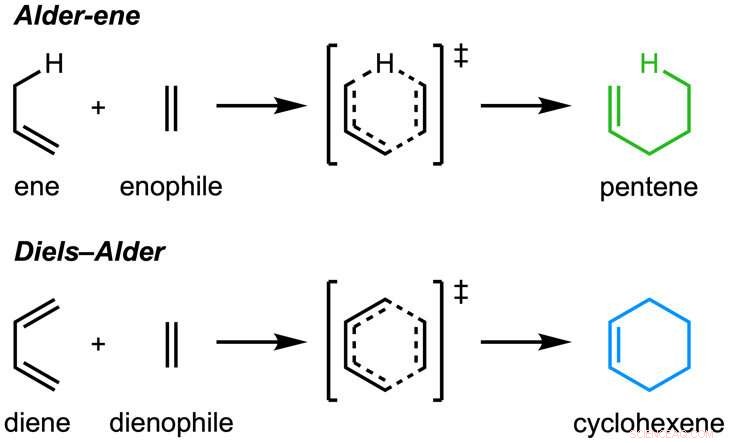
Papiret, "En enzymatisk Alder-ene reaktion" blev offentliggjort i Natur . Alder-ene reaktionen blev opdaget i 1943, men har indtil nu kun været brugt til kemisk syntese i laboratoriet. Alder-en-reaktionen er et eksempel på en pericyklisk reaktion og en analog til den almindeligt kendte Diels-Alder-reaktion. Tidligere, Tang og Houk identificerede en ny klasse af enzymer - pericyclaserne - for deres evne til at accelerere pericykliske reaktioner i primær og sekundær metabolisme.
I et samarbejde med Jiahai Zhou fra Shanghai Institute of Organic Chemistry, Tang-Garg-Houk-grupperne rapporterede strukturer og mekanismer for to grupper af enzymer, der katalyserer en stereoselektiv dehydrering og ledsagende pericyklisk reaktion, vist nedenfor, hvor de små symboler som PdxI indikerer naturlige enzymer (proteinkatalysatorer) opdaget af Tang-gruppen. En gruppe enzymer katalyserer en Alder-en-reaktion, og den anden katalyserer hetero-Diels-Alder-reaktioner.
-
Kredit:University of California, Los Angeles
-

Kredit:University of California, Los Angeles
Artiklen beskriver den divergerende syntese af pyridoxatin og asperpyridon A. Med udgangspunkt i alkoholsubstratet, enzymerne letter en dehydrering for at danne et reaktivt quinon-metid-mellemprodukt, hvorfra pyridoxatin- og asperpyridon A-skeletterne kan dannes ved Alder-en- eller Diels-Alder-reaktion. Masao Ohashi i Tang-gruppen, og Cooper Jamieson i Houk- og Tang-grupperne arbejdede sammen for at identificere de faktorer i enzymerne, der styrer, hvilken reaktion der opstår. Computational forudsigelser guidede eksperimentelle modifikationer, der ændrede enzymerne for at katalysere den anden reaktion. Denne type proteinteknologi lover at påvirke laboratoriesyntesen af relaterede naturlige produkter i fremtiden.
Kredit:University of California, Los Angeles
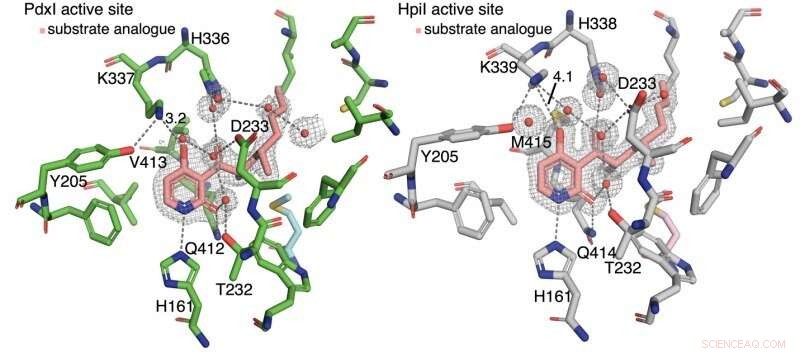
Forfatterne opdagede, at hydrogenbinding til pyridon C4 styrer reaktionstypen. I enzymerne PdxI, AdxI, og MdxI, en lysinrest (K337) hydrogenbinder til C4. Dette reducerer nukleofilicitet af ilten og er ugunstigt for hetero-Diels-Alder-reaktionen. PdxI, AdxI, og MdxI bruger denne strategi til selektivt at danne pyridoxatinskelettet. Enzymer EpiI, UpiI, og HpiI blokerer denne hydrogenbinding i at opstå med en fleksibel methioninrest (M415) og letter derved dannelsen af asperpyridon A-skelettet. Denne subtile geometriske forskel i de aktive steder gør en ret stor elektronisk ændring i substratet og styrer den enzymatiske pericykliske reaktion.
 Varme artikler
Varme artikler
-
 Dræber hydrogenperoxid bakterier?Hydrogenperoxid er vidt brugt til at behandle nedskæringer og skrammer, men nogle kilder advarer om, at det ikke pålideligt dræber alle bakterier og endda kan skade helende væv. Brintperoxidmolekyl
Dræber hydrogenperoxid bakterier?Hydrogenperoxid er vidt brugt til at behandle nedskæringer og skrammer, men nogle kilder advarer om, at det ikke pålideligt dræber alle bakterier og endda kan skade helende væv. Brintperoxidmolekyl -
 Patienter skal springe laboratoriet over, få øjeblikkelige resultater med ny blodprøveteknologiFørste mobile version af Enzyme Linked Immunosorbent Assay (ELISA), guldstandarden i biokemisk analyse. Kredit:Arsenii Zhdanov De ofte dyre, tidskrævende proces med at få blodprøver og urinanalyse
Patienter skal springe laboratoriet over, få øjeblikkelige resultater med ny blodprøveteknologiFørste mobile version af Enzyme Linked Immunosorbent Assay (ELISA), guldstandarden i biokemisk analyse. Kredit:Arsenii Zhdanov De ofte dyre, tidskrævende proces med at få blodprøver og urinanalyse -
 Forskere viser rolle for cyanid i livets oprindelseTodd introducerer et stykke papir til en afstembar UV -lampe for at lokalisere strålen. Kredit:Harvard University Det lyder underligt, men cyanid kan have været en vigtig ingrediens i livets oprin
Forskere viser rolle for cyanid i livets oprindelseTodd introducerer et stykke papir til en afstembar UV -lampe for at lokalisere strålen. Kredit:Harvard University Det lyder underligt, men cyanid kan have været en vigtig ingrediens i livets oprin -
 Ny indsigt i træning af højreaktive kemiske forbindelserDr. Jonas Warneke forklarer kemien bag meget reaktive molekyler, som forskes på Wilhelm Ostwald Instituttet. Kredit:Universität Leipzig Meget reaktive molekyler kan ikke overleve længe i naturen.
Ny indsigt i træning af højreaktive kemiske forbindelserDr. Jonas Warneke forklarer kemien bag meget reaktive molekyler, som forskes på Wilhelm Ostwald Instituttet. Kredit:Universität Leipzig Meget reaktive molekyler kan ikke overleve længe i naturen.
- Cassini rumfartøj:Forstørrelsesglas ved Saturn indtil slutningen
- Virus-ramte Air New Zealand tilbød US$515 mio
- FN-rapport konfronterer nationer med svære valg på klimaområdet
- Havisen udløste den lille istid, finder en ny undersøgelse
- Hvad er en sikker afstand fra elektriske højspændingsledninger?
- Liste nogle måder at fossiler kan bevares


