To-fugle-en-sten-strategien viser lovende i RNA-gentagende ekspansionssygdomme

Alicia Angelbello og Matthew Disney, PhD, i Disney-laboratoriet på Scripps Research's Jupiter, Florida, universitetsområde. Kredit:Scripps Research Institute
En ny strategi til behandling af en række sygdomme kendt som RNA-gentagelsesforstyrrelser, som påvirker millioner af mennesker, har vist lovende i proof-of-principle test udført af forskere ved Scripps Research.
Resultaterne tyder på, at en dag, en håndfuld velmålrettede lægemidler kan muligvis behandle de mere end 40 menneskelige lidelser – inklusive Huntingtons sygdom og varianter af amyotrofisk lateral sklerose (ALS) – der opstår fra RNA-gentagelsesudvidelser.
"Denne undersøgelse lægger et grundlag for udviklingen af lægemidler, der kan adressere flere gentagne ekspansionssygdomme ved at målrette delte unormale strukturer på deres RNA'er, " siger undersøgelsens hovedforsker Matthew Disney, Ph.D., professor i kemi ved Scripps Research.
Ved RNA-gentagende ekspansionssygdomme, mutante gener indeholder overskydende DNA i form af snesevis eller endda hundredvis af gentagne korte strenge af DNA-"bogstaver". I celler, hvor disse mutante gener er aktive, at DNA kopieres ud til RNA-molekyler på vej til at blive oversat til proteiner. De resulterende unormale RNA'er kan forårsage problemer på en række forskellige måder, ved at folde sig sammen til strukturer, der er giftige for celler.
I undersøgelsen, udgivet i Cellekemisk biologi , forskerne viste, at et potentielt lægemiddelmolekyle, de udviklede, kan neutralisere det giftige RNA, der forårsager to forskellige gentagelsesforstyrrelser, myotonisk dystrofi 1 (DM1) og Fuchs endothelial cornea dystrofi (FECD). I sidstnævnte tilfælde, det kan gøre det ved en uventet, men kraftfuld mekanisme.
Genetiske sygdomme, der har hårdt brug for en behandling
DM1 anslås at påvirke omkring 140, 000 mennesker i USA. Det kan manifestere sig overalt fra barndom til voksen alder. Og selvom det ikke altid forkorter levetiden, det medfører ofte et invaliderende sæt symptomer, herunder muskelsvaghed og smerte, grå stær, og luftvejs- og mave-tarmproblemer. Lidelsen er forårsaget af en mutant kopi af et gen kaldet DMPK, hvis RNA'er indeholder snesevis til hundredvis af gentagelser af RNA-bogstaverne "CUG".
FECD, som forårsager progressiv skade på øjets hornhinde, der ofte nødvendiggør hornhindetransplantation, har en relativt høj prævalens; undersøgelser tyder på, at den manifesterer sig hos mindst flere procent af kaukasiske mennesker over 50 år. Lidelsen er forårsaget af en mutant version af et gen kaldet TCF4, hvis RNA'er også indeholder unormalt lange CUG-gentagelser.
Disse lidelser opstår fra forskellige mutante gener, og som følge deraf optræder i forskellige celletyper, men involverer praktisk talt den samme giftige mekanisme:I hvert tilfælde, inklusion af en unormalt lang sekvens af CUG-gentagelser får det RNA, der kopieres fra genet, til at danne strukturer, der er "klæbende" til visse andre proteiner i cellen, og effektivt fange dem – forhindre dem i at udføre deres arbejde i cellen. Udtømningen af et af disse indfangede proteiner, MBNL1, er en særlig vigtig årsag til celleskade og symptomer i DM1 og FECD.
Opmuntrende resultater i prækliniske tests
Til den nye undersøgelse, Disney og hans team brugte avancerede beregningsmetoder til at designe et lille organisk molekyle, der selektivt binder til de unormale CUG-ekspansions-RNA'er, der findes i MD1- og FECD-ramte celler, forhindrer disse RNA'er i at fange MBNL1.
For at evaluere og forbedre molekylet, holdet brugte et unikt værktøj, de havde udviklet tidligere, Konkurrencedygtig Chem-CLIP, hvilket gjorde det muligt for dem at teste deres molekyles evne til selektivt at genkende giftige CUG-ekspansionsstrukturer.
Holdet viste, at i dyrkede celler afledt af patienter med DM1, såvel som i en dyremodel af sygdommen, deres forbedrede designermolekyle reducerede med succes udtømningen af MBNL1 og tabet af dets funktion.
I FECD-celler, lægemiddelmolekylet virkede også på at forhindre tegn på sygdom, men denne gang ved en anden og potentielt mere kraftfuld mekanisme. I FECD-celler, den sygdomsfremkaldende genmutation forekommer i en ikke-kodende del af genet kaldet en intron. Normalt, introner, når de kopieres til RNA, skæres næsten øjeblikkeligt ud af RNA'et og nedbrydes af bortskaffelsessystemer i cellen. I FECD, tilstedeværelsen af CUG-repeat-udvidelsen forhindrer det berørte intron i at blive udskåret. Imidlertid, Disney og hans team fandt ud af, at deres molekyle tillader den udskæring at finde sted, så det unormale RNA-element ikke bare blokeres, men ødelægges.
At målrette mod giftige RNA'er med små organiske molekyler, der kan sættes i pilleform, har generelt været meget udfordrende, indtil nu, Disney noter, men resultatet i denne undersøgelse peger på den lovende mulighed for at bruge sådanne molekyler ikke blot til at blokere dårlige RNA'er, men til at udløse deres ødelæggelse.
"Hvis et lægemiddel får et giftigt RNA til at blive ødelagt i stedet for blot at blokere det, så burde effekten være længerevarende, " han siger.
Efter at have udført deres proof-of-princip demonstration, han og hans hold, som omfatter en nystartet biotekvirksomhed, Ekspansionsterapi, fortsætter med at udvikle det molekyle, der er testet i undersøgelsen, som en potentiel lægemiddelbehandling for DM1 og FECD.
Forskerne tager også en lignende tilgang til at udvikle potentielle lægemiddelbehandlinger for RNA-gentagelses-ekspansionssygdomme, der involverer CAG-gentagelser, som omfatter den progressive og dødelige neurologiske lidelse kendt som Huntingtons sygdom.
Disney bemærker, at hans gruppes beregningsmæssige tilgang til lægemiddelopdagelse, versus traditionelle metoder, der involverer screening af store sæt, eller biblioteker, af molekyler, giver dem en stor fordel:"Vores evne til at lave beregningsstøttet design giver os mulighed for hurtigt at få initiale forbindelser, og test dem hurtigt, " siger Disney.
Sidste artikelForskere udvikler sensorer, der registrerer menneskelige biomarkører og giftig gas
Næste artikelBlyfri magnetiske perovskitter
 Varme artikler
Varme artikler
-
 Ilt-tomgangsmedieret katalyse øger direkte metanering af biomasseKugle og pind model af metan. Kredit:Ben Mills/Public Domain Biomethan (CH 4 ) kan bruges som råmateriale til moderne kemisk industri eller brændes direkte som brændstof. I øjeblikket, CH 4 p
Ilt-tomgangsmedieret katalyse øger direkte metanering af biomasseKugle og pind model af metan. Kredit:Ben Mills/Public Domain Biomethan (CH 4 ) kan bruges som råmateriale til moderne kemisk industri eller brændes direkte som brændstof. I øjeblikket, CH 4 p -
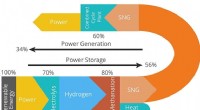 Metan lovende rute til lagring af vedvarende energi fra sol og vindKredit:Utrecht University Lagring af vedvarende elektricitet i molekyler kan løse to problemer på én gang:Først og fremmest miljøskadelig CO 2 kan bruges som råmateriale, og for det andet kan de
Metan lovende rute til lagring af vedvarende energi fra sol og vindKredit:Utrecht University Lagring af vedvarende elektricitet i molekyler kan løse to problemer på én gang:Først og fremmest miljøskadelig CO 2 kan bruges som råmateriale, og for det andet kan de -
 Kulstof-elskende materialer designet til at reducere industrielle emissionerKredit:Oak Ridge National Laboratory Forskere ved Department of Energys Oak Ridge National Laboratory og University of Tennessee, Knoxville, fremmer gasmembranmaterialer for at udvide praktiske te
Kulstof-elskende materialer designet til at reducere industrielle emissionerKredit:Oak Ridge National Laboratory Forskere ved Department of Energys Oak Ridge National Laboratory og University of Tennessee, Knoxville, fremmer gasmembranmaterialer for at udvide praktiske te -
 Hvordan vitaminer, steroider og potentielle antivirale midler kan påvirke SARS-CoV-2Kredit:Pixabay/CC0 Public Domain Der er vidnesbyrd om, at D-vitamin – og muligvis K- og A-vitamin – kan hjælpe med at bekæmpe COVID-19. En ny undersøgelse fra University of Bristol offentliggjort
Hvordan vitaminer, steroider og potentielle antivirale midler kan påvirke SARS-CoV-2Kredit:Pixabay/CC0 Public Domain Der er vidnesbyrd om, at D-vitamin – og muligvis K- og A-vitamin – kan hjælpe med at bekæmpe COVID-19. En ny undersøgelse fra University of Bristol offentliggjort
- Hurtig ødelæggelse af jordlignende atmosfærer af unge stjerner
- Cathay Pacific reducerer 90 % af aprilflyvningerne på grund af virus
- Under pres, bange for at holde badepauser? Inde i Amazons hurtige lagerverden
- Google foreslår privatlivsindstillinger, men afhænger stadig af dine data
- Ny metode til at undersøge klimaændringernes indvirkning på ozonniveauet
- Uventet landbrugsproduktion tillod præ-spansktalende samfund at blomstre i tørre Andesbjerge


