Forskere bestemmer strukturen af glasformende protein i svampe
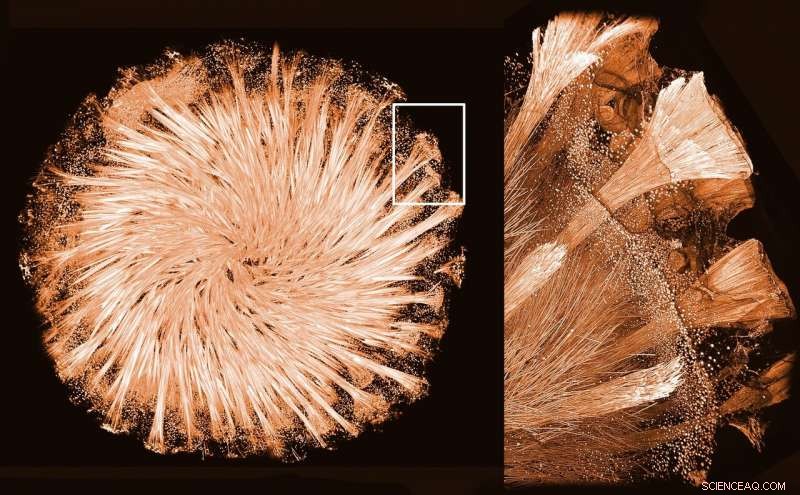
Glas svamp. Kredit:Ronald Seidel/Igor Zlotnikov
Svampe er nogle af de ældste dyr på jorden. De lever i en bred vifte af farvande, fra søer til dybe oceaner. Bemærkelsesværdigt, skelettet af nogle svampe er bygget ud af et netværk af meget symmetriske glasstrukturer. Disse glasstilladser har fascineret forskere i lang tid. Hvordan manipulerer svampe uordnet glas ind i skeletelementerne, som er så regelmæssige? Forskere fra B CUBE—Center for Molecular Bioengineering ved TU Dresden er sammen med holdene fra Center for Advancing Electronics Dresden (cfaed) og den schweiziske lyskilde ved Paul Scherrer Instituttet i Schweiz de første til at bestemme den tredimensionelle (3-D) ) struktur af et protein, der er ansvarlig for glasdannelse i svampe. De forklarer, hvordan de tidligste og, faktisk, den eneste kendte naturlige protein-mineralkrystal dannes. Resultaterne blev offentliggjort i tidsskriftet PNAS .
Glassvampe - som navnet antyder - har et glasbaseret skelet sammensat af et netværk af glasnåle, kroge, stjerner, og kugler. For at opnå sådan en unik arkitektur er de nødt til at manipulere formen af uordnet glas for at danne meget regelmæssige og symmetriske elementer. Tynde krystallinske fibre lavet af et protein, kendt som silicatin, er til stede i kanaler inde i disse glaselementer. Det er kendt, at silicatinkrystaller er ansvarlige for glassyntese i svampe og for at forme glasskelettet. Imidlertid, indtil nu forsøg på at bestemme 3D-strukturen af dette protein, beskriv hvordan det samles til krystaller, og hvordan de danner glasskelettet var mislykkede. Hovedsagelig, fordi ingen var i stand til at reproducere disse krystaller i laboratoriet.
Et team af forskere ledet af Dr. Igor Zlotnikov fra B CUBE-Center for Molecular Bioengineering ved TU Dresden prøvede en usædvanlig tilgang. I stedet for at producere silicatin i laboratoriet og forsøge at skaffe laboratoriedyrkede krystaller for at studere strukturen, forskerne besluttede at tage glasnålene fra et svampeskelet og analysere de små krystaller, der allerede findes indeni.
Zlotnikov-gruppen brugte sammen med forskere fra Dresden Center for Nanoanalysis (DCN) ved Center for Advancing Electronics Dresden (cfaed) højopløsningstransmissionselektronmikroskopi (HRTEM) til at se nærmere på silicatinkrystaller pakket inde i glasnålene. "Vi har observeret en exceptionelt ordnet og samtidig kompleks struktur. Ved at analysere prøven har vi set, at det er en blanding af et organisk og uorganisk stof. Det betyder, at både proteiner og glas danner en hybrid overbygning, der på en eller anden måde former skelettet af svampe. , " forklarer Dr. Zlotnikov.
En traditionel måde at opnå en 3D-struktur af et protein på er at udsætte dets krystal for en stråle af røntgenstråler. Hver proteinkrystal spreder røntgenstrålerne på en anden måde og giver et unikt øjebliksbillede af dets interne arrangement. Ved at dreje krystallen og indsamle sådanne snapshots fra mange vinkler, forskerne kan bruge beregningsmetoder til at bestemme 3D-proteinstrukturen. En sådan tilgang er meget udbredt og er grundlaget for moderne strukturbiologi. Det fungerer godt til krystaller på mindst 10 mikron i størrelse. Imidlertid, Zlotnikov-gruppen ønskede at analysere silicatinkrystaller, som var omkring 10 gange mindre. Når de blev udsat for røntgenstråler, blev de næsten øjeblikkeligt beskadiget, gør det umuligt at indsamle et komplet datasæt af snapshots fra flere vinkler.
Med støtte fra teamet hos PSI's Swiss Light Source (SLS), forskerne brugte en ny fremspirende metode kendt som seriel krystallografi. "Du kombinerer diffraktionsbilleder fra mange krystaller, " siger Filip Leonarski, strålelinjeforskere ved PSI, hvem der var involveret i undersøgelsen. "Med den traditionelle metode optager du en film. Med den nye metode får du mange snapshots, som du kombinerer bagefter for at tyde strukturen." Hvert snapshot er taget på en anden del af den lille krystal eller endda fra en anden krystal.
I alt, forskerne indsamlede mere end 3500 individuelle røntgendiffraktionssnapshots fra 90 glasnåle i helt tilfældige orienteringer. Ved at bruge state-of-the-art beregningsmetoder var de i stand til at finde orden i kaosset og samle dataene for at bestemme den første komplette 3D-struktur af silicatin.
"Før denne undersøgelse, strukturen af silicatin blev antaget baseret på dets lighed med andre proteiner, " siger Dr. Zlotnikov. Ved at bruge den nyligt opnåede 3D-struktur af silicatin, forskerne var i stand til at forstå dens samling og funktion inde i svampens glasskelet. De byggede en beregningsmodel af overbygningen i glasnålen og forklarede de indledende komplekse billeder af protein-glas-overbygningerne opnået med HRTEM.
"Vi gav detaljerede oplysninger om eksistensen af en funktionel 3-D protein-glas overbygning i en levende organisme. Faktisk, hvad vi beskriver er den første kendte naturligt forekommende hybride mineral-protein krystallinske samling, " konkluderer Dr. Zlotnikov.
 Varme artikler
Varme artikler
-
 Sådan får du det samlede antal valenser på en forbindelseI kemi er en forbindelses valensnummer antallet af bindinger dannet af elektronerne i den sidste (ydre) skal (kaldet valenselektroner) af atomer til andre atomer valenselektroner . Oktetreglen (et ato
Sådan får du det samlede antal valenser på en forbindelseI kemi er en forbindelses valensnummer antallet af bindinger dannet af elektronerne i den sidste (ydre) skal (kaldet valenselektroner) af atomer til andre atomer valenselektroner . Oktetreglen (et ato -
 Design af næste generation af hårfarverTova Williams, en ph.d. studerende ved North Carolina State University, laver forskning, der er relevant for de 75 procent af amerikanske kvinder, der farver deres hår, og de stylister, der anvender d
Design af næste generation af hårfarverTova Williams, en ph.d. studerende ved North Carolina State University, laver forskning, der er relevant for de 75 procent af amerikanske kvinder, der farver deres hår, og de stylister, der anvender d -
 EPDM Washer vs. Nitrile Rubber WasherSyntetisk gummi findes i næsten et dusin hovedtyper med forskellige egenskaber til forskellige anvendelser. To almindelige syntetiske gummiforbindelser er kendt som EPDM og nitrilgummi. De største for
EPDM Washer vs. Nitrile Rubber WasherSyntetisk gummi findes i næsten et dusin hovedtyper med forskellige egenskaber til forskellige anvendelser. To almindelige syntetiske gummiforbindelser er kendt som EPDM og nitrilgummi. De største for -
 Hvordan påvirker saltholdigheden opløseligheden af ilt i vand?Saltholdigheden af en hvilken som helst væske er et skøn over koncentrationen af opløste salte, den indeholder. For ferskvand og havvand er de omhandlede salte normalt natriumchlorid, kendt som al
Hvordan påvirker saltholdigheden opløseligheden af ilt i vand?Saltholdigheden af en hvilken som helst væske er et skøn over koncentrationen af opløste salte, den indeholder. For ferskvand og havvand er de omhandlede salte normalt natriumchlorid, kendt som al
- Svovlfjernende bakterier kan være nøglen til at lave fælles komponent i plastik
- Styrende partikler til rettet selvsamling af kolloide krystaller
- Der var nogle usandsynlige, men meget heldige overlevende fra Notre Dame Fire
- Tingene stables op for NASAs Mars 2020-rumfartøjer
- Great Barrier Reef, et aktiv på $42 milliarder, der er for stort til at mislykkes:studie
- Stort skridt i retning af at producere kulstofneutralt stål med grøn brint


