Kemikere lykkes med syntese af aminoalkoholer ved at udnytte lys
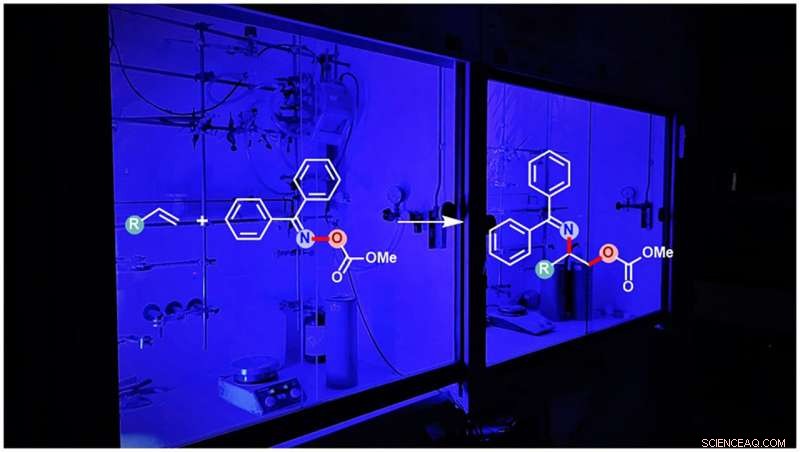
Fotosensibiliseret syntese af beskyttede aminoalkoholer. Kredit:WWU - Glorius Group
Uanset om det er i betablokkere til behandling af forhøjet blodtryk eller i naturlige produkter, såkaldte vicinale aminoalkoholer er organiske forbindelser af høj kvalitet, som findes i mange hverdagsting. Imidlertid, deres produktion er vanskelig, og i lang tid, kemikere har forsøgt at udvikle effektive metoder til at syntetisere dem. I deres nylige undersøgelse offentliggjort i tidsskriftet Naturkatalyse , videnskabsmænd ledet af prof. Dr. Frank Glorius fra Münster Universitet har fundet en løsning til fremstilling af en speciel variant af aminoalkoholer. "Den nye metode hjælper med at studere stoffets egenskaber og finde anvendelser for disse nye forbindelser i fremtiden, " understreger Glorius fra Organic Chemistry Institute ved Münster University.
Vicinale aminoalkoholer kan forekomme i to forskellige varianter - kaldet regioisomerer - hvori de funktionelle amin- og alkoholgrupper udveksler positioner. Selvom de således er meget ens, de har ofte forskellige biokemiske egenskaber. Installation af både amin- og alkoholgrupper i ét trin udgør en stor udfordring. Opdagelsen af den asymmetriske aminohydroxideringsreaktion, hvormed en af regioisomererne kan fremstilles, resulterede endda i en Nobelpris til kemikeren Barry Sharpless i 2001. den anden regioisomer kan ikke syntetiseres ved en lignende metode og forblev et langvarigt problem - indtil nu. Ved hjælp af kemikernes nye foto-initierede reaktionsmetode, syntesen af den anden regioisomer er nu også blevet effektivt mulig.
Uaktiverede alkener indeholdende en carbon-carbon dobbeltbinding er kendt som råstofkemikalier til reaktionsprocesser på grund af deres gode tilgængelighed. Generelt, installationen af både amin- og alkoholgrupper i ét trin via denne carbon-carbon-dobbeltbinding af uaktiveret alken er til enhver tid initieret af amingruppen, efterfulgt af tilføjelse af alkoholgruppen. Som resultat, en bestemt regioisomer af den vicinale aminoalkohol dannes altid. Nu har forskerne identificeret en særlig klasse af aminlignende forbindelser, der er reaktive, men stabile nok til først at tillade tilføjelsen af alkoholgruppen til carbon-carbon-dobbeltbindingen, efterfulgt af tilføjelsen af amingruppen for at generere den tidligere utilgængelige modsatte regioisomer af de vicinale aminoalkoholer.
"Ligesom planter bruger klorofyl til at omdanne lys til energi, vi bruger det, der kaldes en fotokatalysator, " forklarer Dr. Tuhin Patra, første forfatter til denne undersøgelse. "Denne art kan absorbere lyset fra blå LED'er og overføre dets energi til et molekyle, der er direkte involveret i reaktionen. Dette frigiver samtidig amin- og alkoholgrupperne." denne proces, hvor molekylerne overfører elektroner til hinanden, kaldes energioverførsel, forklarer videnskabsmanden.
Fascinerende nok, den nye metode genererer den mindst tilgængelige regioisomer af de vicinale aminoalkoholer på en sådan måde, at både alkohol- og amingrupperne er beskyttet mod yderligere reaktioner. Afhængigt af brugerens behov, en af de to alkohol- eller amingrupper kan nu reaktiveres uden at påvirke den anden. Imidlertid, selv begge grupper kan aktiveres til at reagere yderligere på samme tid, hvis det er nødvendigt for syntesen af yderligere krav. "Tidligere designs installerer normalt kun én gruppe ad gangen i en kompleks flertrins overordnet proces. Vores design tillader ikke kun installation af to forskellige grupper i ét trin med ønsket beskyttelse, men genererer også pålideligt den mindst tilgængelige regioisomer, giver mulighed for at undersøge fremtidige anvendelser af denne forbindelse, " slutter Glorius.
 Varme artikler
Varme artikler
-
 NIST finder en måde at måle brændselscelleudskrivning ved et hurtigt klipGodt kontrolleret belysning gør det muligt for teamets prototype-enhed (øverst til venstre) at scanne tynde lag væske, der indeholder platin-nanopartikler (nederste center), en katalysator, der bruges
NIST finder en måde at måle brændselscelleudskrivning ved et hurtigt klipGodt kontrolleret belysning gør det muligt for teamets prototype-enhed (øverst til venstre) at scanne tynde lag væske, der indeholder platin-nanopartikler (nederste center), en katalysator, der bruges -
 Forskere producerer robust katalysator til at spalte vand til brint, iltEn katalysator udviklet af Rice University og University of Houston opdeler vand til brint og oxygen uden behov for dyre metaller som platin. Dette elektronmikroskopbillede viser nikkelskum belagt med
Forskere producerer robust katalysator til at spalte vand til brint, iltEn katalysator udviklet af Rice University og University of Houston opdeler vand til brint og oxygen uden behov for dyre metaller som platin. Dette elektronmikroskopbillede viser nikkelskum belagt med -
 Ny forskning forklarer, hvorfor nogle molekyler har uregelmæssige formerKredit:Vanderbilt University Der er altid en grund til, hvordan molekyler dannes, og hvordan de er formet. Når først forskere forstår bindingerne i molekyler, de finder ud af måder at bruge de mat
Ny forskning forklarer, hvorfor nogle molekyler har uregelmæssige formerKredit:Vanderbilt University Der er altid en grund til, hvordan molekyler dannes, og hvordan de er formet. Når først forskere forstår bindingerne i molekyler, de finder ud af måder at bruge de mat -
 At se det usynlige – Et nyt gasbilleddannelsessystem(a) Detektionsprincip for EtOH baseret på den ADH-medierede katalytiske reaktion. (b) Skematisk diagram af skin-gas-kammen. (c) Arbejdsmekanisme af todimensionel (2D) Mako. (d) Sammenfatning af svedha
At se det usynlige – Et nyt gasbilleddannelsessystem(a) Detektionsprincip for EtOH baseret på den ADH-medierede katalytiske reaktion. (b) Skematisk diagram af skin-gas-kammen. (c) Arbejdsmekanisme af todimensionel (2D) Mako. (d) Sammenfatning af svedha
- Hollandske familier slutter sig til folks gård for at modvirke klimaændringer
- Ingeniører gør et gyldent gennembrud for at forbedre elektroniske enheder
- Hvilke blomster synes bier?
- Sådan fungerer 2-D stregkoder
- Hvordan man skriver en kemisk formel
- Renault, Nissan, Mitsubishi løfter sløret for ny fælles bestyrelse efter Ghosn


