Højhastigheds atomkraftmikroskopi visualiserer celleproteinfabrikker
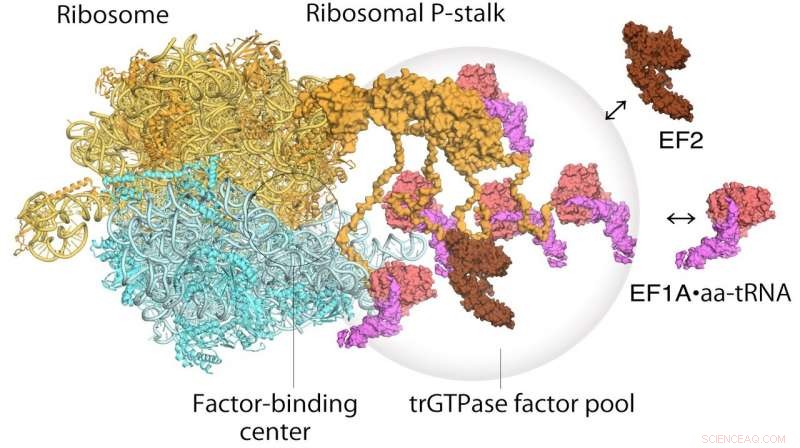
Model til oversættelse af ribosomer og forlængelsesfaktorer. EF1A • GTP • aatRNA og EF2 samles til den ribosomale stilk på det translaterende ribosom. Oversættelsesfaktorpuljen bidrager til effektiv proteinsyntese i et overfyldt intracellulært miljø. Kredit: Proceedings of the National Academy of Sciences
Ribosomer er komplekserne af ribonukleoproteiner i hjertet af proteinsyntese i celler. Imidlertid, i mangel af afgørende beviser, hvordan disse komplekser fungerer har været åben for debat. Nu, Hirotatsu Imai og Noriyuki Kodera ved Kanazawa University, sammen med Toshio Uchiumi ved Niigata University i Japan, vise visualiseringer af den strukturelle dynamik og faktorpooling, der finder sted ved ribosomstængelproteiner, når de bygger nye proteiner.
Ribosomer blev først opdaget i 1950'erne, og deres brede funktion har været almindeligt forstået i nogen tid - de læser messenger RNA-sekvenser, og fra det, generere sekvenser af korrekt ordnede aminosyrer til nye proteiner. Ribosomstilkproteinet spiller især en integreret rolle i proteinsynteseprocessen ved at rekruttere proteinfaktorer, der er ansvarlige for translation og forlængelse af aminosyresekvensen. Imidlertid, det har været svært at fastslå strukturen af det bundne ribosomstilkprotein på grund af dets fleksibilitet. Her, den høje opløsning og hurtige billedoptagelse af højhastigheds atomkraftmikroskopi viste sig at være uvurderlig.
Atomkraftmikroskopi bruger en nanoskala til at spore prøverne, meget ligesom en vinylpladespiller nålescanning over en plade, bortset fra at detaljerne identificeret af et atomkraftmikroskop kan have opløsning i atomskala. Teknikkens alsidighed til forskellige overflader var allerede en stor fordel for biologiske undersøgelser, men med fremkomsten af højhastigheds atomkraftmikroskopi, teknikken var i stand til at fange dynamiske processer for første gang, såvel. Imai, Uchiumi og Kodera brugte teknikken til at afsløre, at stilkproteinet faktisk vender mellem to konformationer - en, der stemmer overens med tidligere strukturelle modeller, og en helt uventet ny konformation.
Med hensyn til hvordan ribosomet fungerer, en to-trins mekanisme var tidligere blevet foreslået til at beskrive, hvordan genetisk information oversættes gennem proteiner kendt som translationelle GTPase-faktorer. Det første trin er rekruttering af faktorerne til faktorbindingsstedet på proteinstammen, og derved øge koncentrationen af faktorer der-såkaldt faktor-pooling. Det andet trin er binding og stabilisering af en translationel GTPase på det ribosomale faktorbindingscenter for at katalysere GTPase-hydrolyse. Fra deres højhastigheds atomkraftmikroskopi undersøgelse, forskerne var i stand til at opnå det første visuelle bevis for den translationelle GTPase-faktor-poolingsmekanisme ved hjælp af den ribosomale stilk.
Selvom undersøgelsen ikke var i stand til at give afgørende bevis for virkningen af faktorerne, når de først var bundet, forskerne bemærkede, at faktorerne syntes at være fastholdt i nærheden, når GTPase -hydrolyse var fuldført, hvilket tyder på en potentiel rolle for stilkproteinet i yderligere stadier af proteinsyntese. Forskerne konkluderer, "Fremtidigt arbejde med HS-AFM vil give yderligere vigtig information for at forstå den dynamiske adfærd i disse komplekse translationelle maskiner."
 Varme artikler
Varme artikler
-
 Neutroner giver indsigt i øget ydeevne for hybride perovskit-solcellerNeutroninteraktioner afslørede den orthorhombiske struktur af hybridperovskit stabiliseret af de stærke hydrogenbindinger mellem nitrogensubstituenten af methylammoniumkationerne og bromiderne på de
Neutroner giver indsigt i øget ydeevne for hybride perovskit-solcellerNeutroninteraktioner afslørede den orthorhombiske struktur af hybridperovskit stabiliseret af de stærke hydrogenbindinger mellem nitrogensubstituenten af methylammoniumkationerne og bromiderne på de -
 Sådan fremstilles glycerin ud fra vegetabilsk olieGlycerin eller glycerol er en farveløs og lugtfri sirup, der smager sød og er et biprodukt fra forsæbning - processen med at fremstille sæbe - af naturlige fedtstoffer, såsom vegetabilsk olie. Du kan
Sådan fremstilles glycerin ud fra vegetabilsk olieGlycerin eller glycerol er en farveløs og lugtfri sirup, der smager sød og er et biprodukt fra forsæbning - processen med at fremstille sæbe - af naturlige fedtstoffer, såsom vegetabilsk olie. Du kan -
 Bioingeniører udvikler sig hurtigt, spyt-baseret detektionstest for marihuanaKredit:University of Texas i Dallas Dr. Shalini Prasad (forrest), midlertidig afdelingsleder for bioingeniør ved Erik Jonsson School of Engineering and Computer Science, har den THC-biosensor, som
Bioingeniører udvikler sig hurtigt, spyt-baseret detektionstest for marihuanaKredit:University of Texas i Dallas Dr. Shalini Prasad (forrest), midlertidig afdelingsleder for bioingeniør ved Erik Jonsson School of Engineering and Computer Science, har den THC-biosensor, som -
 Kemiker skaber nye katalysatorer til klikreaktionerKredit:RUDN University En kemiker fra RUDN University har skabt en række katalysatorer til klikkemi. Disse reaktioner er meget udbredt i syntesen af biologisk aktive stoffer, såvel som i biologi
Kemiker skaber nye katalysatorer til klikreaktionerKredit:RUDN University En kemiker fra RUDN University har skabt en række katalysatorer til klikkemi. Disse reaktioner er meget udbredt i syntesen af biologisk aktive stoffer, såvel som i biologi
- Optiske teknikker giver hurtige, effektiv COVID-19-detektion
- Forskere løser udfordringen med at forbedre fusionsydelsen
- Når temperaturen bliver kvante
- En ny robotmanet, der er i stand til at udføre 3D-fremdrift og manøvrer
- Svært at løse en Rubiks -terning? Prøv den adaptive værktøjskasseteori om rationalitet
- Anti-asiatisk diskrimination stiger i Canada, siger sociolog


