Forskere opdager en ny mekanisme til at rekruttere ARF-familieproteiner
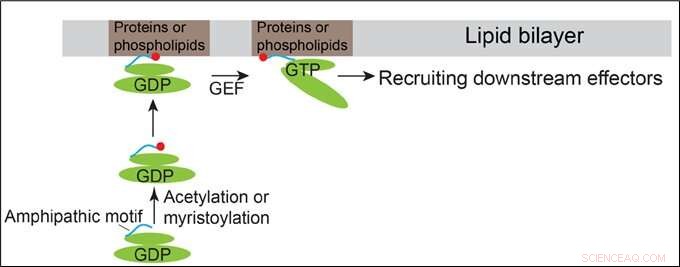
Model, der viser, hvordan Arfrp1 og Arl14 rekrutteres til membranerne. Kredit:HKUST
De små GTPaser af ADP-ribosyleringsfaktor (Arf) familien er nøgleinitiatorer af forskellige fysiologiske processer, herunder sekretion, endocytose, fagocytose og signaltransduktion. Arf -familiens proteiner fungerer til at formidle rekruttering af cytosoliske effektorer til specifikke subcellulære rum. Denne proces gør det lettere for Arf-effektorer at udføre lastgenkendelse, lipidmodifikation eller andre cellulære funktioner.
Blokering af aktiviteterne af Arf-familiens proteiner hæmmer sekretion af vigtige molekyler fra cellen og hæmmer også cellulær optagelse af næringsstoffer. Defekter i Arfs eller deres regulerende proteiner er relateret til forskellige arvelige sygdomme, herunder X-linked intellektuel handicap (XLID), Joubert syndrom, Bardet-Biedl syndrom og cilia dysfunktion. Dermed, at studere molekylære mekanismer for Arf-regulerede intracellulære aktiviteter repræsenterer en mulighed for at forstå disse sygdommers ætiologi og udvikle nye terapeutiske strategier.
Arf-familieproteiner kredser mellem en GDP-bundet inaktiv tilstand og en GTP-bundet aktiv tilstand. De har lignende strukturelle organisationer, der indeholder et N-terminalt amfipatisk helix-motiv og switch-domænerne. Switch-domænerne af Arf-proteiner binder direkte deres tilsvarende guanidin-nukleotid-udvekslingsfaktorer (GEF'er), hvilket gør det muligt for Arf -proteiner at binde GTP. Det antages generelt, at membranrekruttering af Arf-proteiner initieres af GTP-bindingsinducerede konformationelle ændringer af Arf-proteiner.
Ud over denne konventionelle mekanisme, Prof Guo og hans team opdagede, at de N-terminale amfipatiske motiver af det Golgi-lokaliserede Arf-familieprotein, Arfrp1, og det endosom- og plasmamembran-lokaliserede Arf-familieprotein, Arl14, er tilstrækkelige til at bestemme specifikke subcellulære lokaliseringer på en GTP-uafhængig måde. Udveksling af de amfipatiske helixmotiver mellem disse to Arf -proteiner forårsager skift af deres lokaliseringer. Den rumlige bestemmelse medieret af Arfrp1-helixen kræver dens bindingspartner Sys1. Ud over, undersøgelsen indikerer, at acetyleringen af Arfrp1 helixen og myristoyleringen af Arl14 helixen er vigtige for den specifikke subcellulære lokalisering. En foreslået model repræsenterer membranrekruttering af Arfrp1 og Arl14.
Denne undersøgelse afdækker ny indsigt i det molekylære maskineri, der regulerer membranforeningen af nogle Arf -proteiner, hvilket tyder på, at membranassociationen og aktiveringen af nogle Arf -proteiner er koblet fra. Denne undersøgelse tilbyder også nye korte motiver til målretning af proteiner til specifikke intracellulære lokaliseringer.
Resultaterne blev for nylig offentliggjort i det videnskabelige tidsskrift Journal of Biological Chemistry .
 Varme artikler
Varme artikler
-
 Biokemiker opdager et lovende enzym til at bekæmpe kræftcellerKredit:RUDN Universitet En biokemiker fra RUDN Universitet har undersøgt kemiske stoffers stimulerende virkning på det kataboliske enzym PAO (polyaminoxidase). Resultaterne kan bidrage til udvikli
Biokemiker opdager et lovende enzym til at bekæmpe kræftcellerKredit:RUDN Universitet En biokemiker fra RUDN Universitet har undersøgt kemiske stoffers stimulerende virkning på det kataboliske enzym PAO (polyaminoxidase). Resultaterne kan bidrage til udvikli -
 Fremme nitrogenoxidelektroreduktion til ammoniak over elektronrigt Cu moduleret af Ru-dopingSkematisk illustration til at fremme nitrogenoxidelektroreduktion til ammoniak over ved Ru-doping. Kredit:Science China Press Som et vigtigt nitrogenholdigt kemikalie, ammoniak spiller en afgørend
Fremme nitrogenoxidelektroreduktion til ammoniak over elektronrigt Cu moduleret af Ru-dopingSkematisk illustration til at fremme nitrogenoxidelektroreduktion til ammoniak over ved Ru-doping. Kredit:Science China Press Som et vigtigt nitrogenholdigt kemikalie, ammoniak spiller en afgørend -
 Smartphone-app bringer atomer og molekyler til live som aldrig førKredit:University of Sheffield En ny smartphone-app, der gør det muligt for folk at se, hvordan atomer og molekyler bevæger sig i verden omkring dem i hidtil uset detalje, er blevet udviklet af fo
Smartphone-app bringer atomer og molekyler til live som aldrig førKredit:University of Sheffield En ny smartphone-app, der gør det muligt for folk at se, hvordan atomer og molekyler bevæger sig i verden omkring dem i hidtil uset detalje, er blevet udviklet af fo -
 Forskere skaber en unik legering til luft, jernbanetransporterTorgom Akopyan, seniorforsker ved NUST MISIS Institut for Metalformning. Kredit:Sergey Gnuskov, SKAL IKKE MISIS Forskere fra National University of Science and Technology MISIS (NUST MISIS) i sama
Forskere skaber en unik legering til luft, jernbanetransporterTorgom Akopyan, seniorforsker ved NUST MISIS Institut for Metalformning. Kredit:Sergey Gnuskov, SKAL IKKE MISIS Forskere fra National University of Science and Technology MISIS (NUST MISIS) i sama
- Opdagelse af stjerneklynger kan forstyrre den astronomiske applecart
- Enkel forberedelse, hurtige lasere overvinder analysevejspærring
- For nogle videnskabsmænd, Mars 2020 er en udholdenhedsmission
- Sådan beregnes konduktivitet på grund af koncentration
- Huawei nægter sig skyldig i anklager om forretningshemmeligheder i Seattle
- Douglas A-4 Skyhawk


