Højopløsningsstrukturer af archaerhodopsin-3-proteinet kaster nyt lys over receptordesensibilisering

Krystaller af AR3 observeret under polariseret lys (venstre). Kredit:Copyright til billederne ligger hos forfatterne i henhold til Nature Communications vilkår og betingelser
For første gang, et internationalt team af forskere har visualiseret det lysfølsomme protein archaerhodopsin-3 (AR3) med hidtil uset opløsning ved hjælp af I24- og B23-strålelinjerne ved Diamond Light Source. Fotoreceptoren udtrykkes af Halorubrum sodomense, en organisme, der vokser i Det Døde Hav, men er bedst kendt for sine anvendelser i optogenetiske eksperimenter, hvor det bruges til at dæmpe individuelle neuroner og til at detektere ændringer i cellemembranspænding. Disse nye strukturer åbner vejen for udvikling af nye værktøjer og metoder inden for neurovidenskab, cellebiologi og videre.
I deres papir, offentliggjort i dag i Naturkommunikation , holdet rapporterer den første struktur nogensinde i grundtilstanden for AR3. I denne tilstand, proteinet er konfigureret til at transportere en H + ion over cellemembranen for hver foton absorberet. Holdet var også i stand til at krystallisere fotoreceptoren i en anden konformation, en desensibiliseret tilstand, der overtages af AR3 i langvarig fravær af lys.
Tilsvarende forfatter prof. Anthony Watts fra Oxford University siger; "Den fremragende opløsning, som vi har opnået for disse AR3-strukturer, 1,07 Å for grundtilstanden, er blandt de højeste for et vildtype-membranprotein, der hidtil er deponeret i proteindatabanken. Denne kvalitet giver os mulighed for direkte at visualisere den komplekse fordeling af vandmolekyler inde i receptoren og beskrive den funktionelle betydning af de indviklede netværk af hydrogenbindinger, som de danner, noget, der er af betydning i mange biomolekyler - ikke kun fotoreceptorer. Disse netværk i AR3 involverer interaktioner med retinalgruppen og aminosyresidekæder og, i denne avis, vi har vist, hvordan de ændres mellem jordens og desensibiliserede tilstande af proteinet."
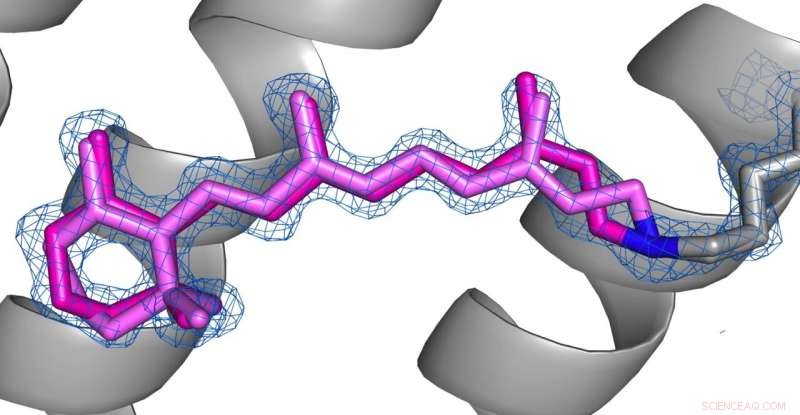
Sammenligning af konformationerne af retinal (lyserød) i desensibiliseret tilstand (billede 1) og grundtilstand (billede 2) af AR3. Kredit:Copyright til billederne ligger hos forfatterne i henhold til Nature Communications vilkår og betingelser
Forklaring af betydningen af AR3-proteinet, fælles-første forfatter Dr. Juan Francisco Bada Juarez kommentarer; "Den spændende udvikling inden for optogenetik i det seneste årti har ført til intens interesse for AR3 fra forskere over hele verden. Mutanter af proteinet bruges rutinemæssigt i neurovidenskabelige eksperimenter til selektivt at dæmpe individuelle nerveceller og også til at detektere ændringer i transmembranspænding. Men , disse mutanter er designet uden viden om selve proteinets struktur. Vores data giver strukturelle biologer og proteiningeniører 'blueprints' til AR3 og, som resultat, vi kan forvente en betydelig acceleration i udviklingen af nye optogenetiske værktøjer."
Medkorresponderende forfatter Dr. Isabel Moraes fra National Physical Laboratory (NPL) tilføjer:
"De meget højopløselige diffraktionsdata har gjort os i stand til i detaljer at observere bevægelsesfriheden af flere vigtige aminosyrer og individuelle vandmolekyler inde i fotoreceptoren. At løse AR3-strukturerne var ekstremt udfordrende, på grund af kompleksiteten af de funktioner, som vi kan skelne ved atomopløsning. Mange aminosyresidekæder inde i proteinet blev opløst i mere end én position eller orientering, angiver deres betydning for proteinfunktionen. Viden om dynamikken i disse grupper var nøglen til at forstå, hvordan processerne med sensibilisering og desensibilisering finder sted."
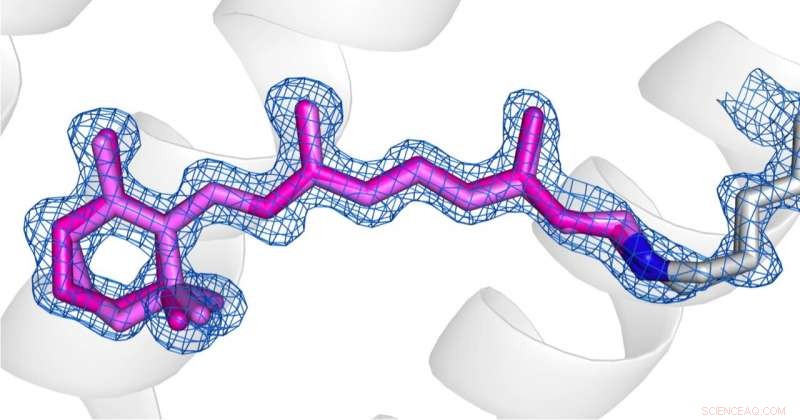
Sammenligning af konformationerne af retinal (lyserød) i desensibiliseret tilstand (billede 1) og grundtilstand (billede 2) af AR3. Kredit:Copyright til billederne ligger hos forfatterne i henhold til Nature Communications vilkår og betingelser
Vigtigt for at forstå proteinets funktion, var de højopløselige krystalstrukturer løst af holdet. At opnå sådanne højkvalitetsdiffraktionsdata ville ikke have været muligt uden den avancerede mikrofokusstrålelinje ved Diamond Light Source, Storbritanniens nationale synkrotron, nær Didcot i Oxfordshire. Holdet arbejdede tæt sammen med flere eksperter hos Diamond.
"Mikrokrystallerne dyrket af Oxford- og NPL-holdene var perfekt egnede til I24-strålelinjens muligheder. Ved at bruge software udviklet af DIALS-softwareudviklingsgruppen hos Diamond, vi var i stand til at kombinere diffraktionsbilleder fra flere krystaller for at opnå komplette datasæt. Kombinationen af præcis mikrofokus røntgenafgivelse og avanceret dataanalyse gjorde det muligt for os at presse opløsningen af de resulterende strukturer til det yderste." siger Diamond Senior Beamline Scientist Dr. Danny Axford.
Afslutningsvis tilføjer prof. Watts:"Dette har været en fascinerende undersøgelse. Det har været en fornøjelse at arbejde sammen med så mange ekspertkolleger både i Storbritannien og rundt om i verden. Ikke alene har vi nu en meget detaljeret viden om strukturerne af to vigtige funktionelle tilstande af AR3, men den opnåede indsigt uddyber vores forståelse af, hvordan processerne med sensibilisering og desensibilisering forekommer i mange andre receptorproteiner."
 Varme artikler
Varme artikler
-
 Er antivitaminer det nye antibiotika?Kredit:CC0 Public Domain Antibiotika er blandt de vigtigste opdagelser af moderne medicin og har reddet millioner af liv siden opdagelsen af penicillin for næsten 100 år siden. Mange sygdomme fo
Er antivitaminer det nye antibiotika?Kredit:CC0 Public Domain Antibiotika er blandt de vigtigste opdagelser af moderne medicin og har reddet millioner af liv siden opdagelsen af penicillin for næsten 100 år siden. Mange sygdomme fo -
 Selvhelbredende omvendt filter åbner døren for mange nye anvendelserSelvhelbredende omvendt filter tillader store partikler igennem, men udelukker mindre partikler og gasser. Kredit:Tak-Sing Wong/Birgitt Boschitsch, Penn State En selvhelbredende membran, der funge
Selvhelbredende omvendt filter åbner døren for mange nye anvendelserSelvhelbredende omvendt filter tillader store partikler igennem, men udelukker mindre partikler og gasser. Kredit:Tak-Sing Wong/Birgitt Boschitsch, Penn State En selvhelbredende membran, der funge -
 Inde i brændselscellen:Imaging metode lover industriel indsigtHydrogenholdige stoffer er vigtige for mange industrier, men forskere har kæmpet for at få detaljerede billeder for at forstå elementets adfærd. I gennemgang af videnskabelige instrumenter, forskere d
Inde i brændselscellen:Imaging metode lover industriel indsigtHydrogenholdige stoffer er vigtige for mange industrier, men forskere har kæmpet for at få detaljerede billeder for at forstå elementets adfærd. I gennemgang af videnskabelige instrumenter, forskere d -
 10 typer fysisk ændring <p> <p> Det kan være vanskeligt at fortælle forskellen mellem en fysisk æ…Frysning eller størkning er tilbagetrækning af varme fra et stof for at ændre dette stof fra en væske til et fast stof . Temperaturen skal være under stoffets frysepunkt for at ændringen kan finde ste
10 typer fysisk ændring <p> <p> Det kan være vanskeligt at fortælle forskellen mellem en fysisk æ…Frysning eller størkning er tilbagetrækning af varme fra et stof for at ændre dette stof fra en væske til et fast stof . Temperaturen skal være under stoffets frysepunkt for at ændringen kan finde ste
- Facebook -chef står over for, at EU griller over sit digitale monster
- Tsunamier og tsunami-advarsel:Seneste fremskridt og fremtidsudsigter
- Vender det evolutionære ur tilbage på et lysfølsomt protein
- Fracking kan forårsage jordskælv snesevis af kilometer væk - ny forskning
- Fra biler til Mars:Hvad der er godt for F1, er godt for livet i hele universet
- En biobank af reversible mutante embryonale stamceller


