Kryo-elektronmikroskopisk struktur af en protonaktiveret kloridkanal ved navn TMEM206
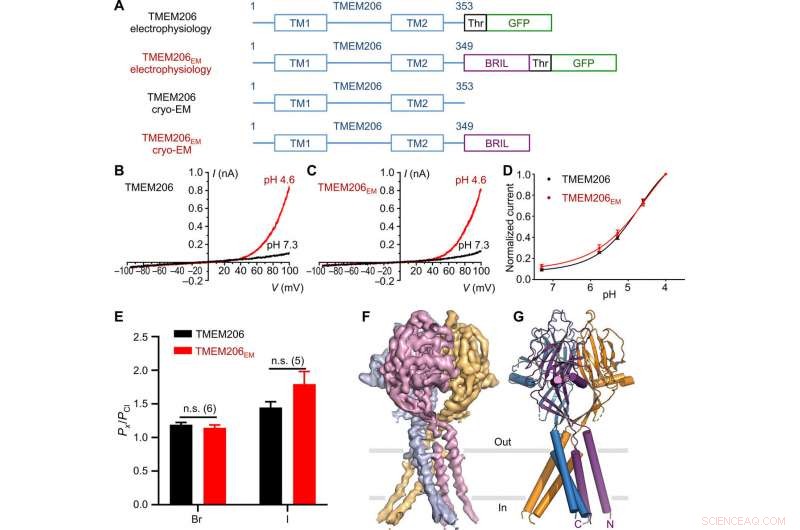
Funktion og struktur af pufferfish TMEM206. (A) Skematisk af kanalkonstruktioner, der anvendes til elektrofysiologi og enkeltpartikel-kryo-EM-eksperimenter. "Thr" repræsenterer et thrombin-spaltningssted. (B og C) Repræsentative helcellestrømspor aktiveret af ekstracellulær pH 4,6 for pufferfish TMEM206 (B) og TMEM206EM (C). Kanalkonstruktioner blev udtrykt i TMEM206 knockout humane embryonale nyre (HEK) 293T-celler. (D) Normaliserede strøm-til-pH-forhold af pufferfish TMEM206 (n =6 til 9 celler pr. datapunkt) og TMEM206EM (n =5 til 6 celler pr. datapunkt). Alle strømme blev registreret ved stuetemperatur og normaliseret til pH 4,0 strømme ved +100 mV. (E) Anionselektivitet for pufferfish TMEM206 og TMEM206EM. Data præsenteres som middel ± SEM (n.s., ikke signifikant; Elevens t-test). (F) Cryo-EM-densitet af pufferfish TMEM206EM kontureret ved 7,0 σ og farvet af individuelle underenheder. (G) Trimerisk struktur af pufferfish TMEM206EM. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.abe5983
Det transmembrane protein 206 forkortet til TMEM206 er en evolutionært konserveret chloridkanal, der ligger til grund for den allestedsnærværende udtrykte, proton-aktiveret, udadrettede anionstrømme. I en ny rapport, der nu er offentliggjort den Videnskabens fremskridt , Zengqin Deng og et tværfagligt forskerhold ved Washington University School of Medicine, i Saint Louis, U.S. beskrev kryo-elektronmikroskopi (cryo-EM) strukturen af pufferfish TMEM206. Strukturen dannede en trimer kanal med to transmembrane segmenter og et stort ekstracellulært domæne. Ifølge resultaterne, Deng et al. viste, hvordan en rigelig vestibule i det ekstracellulære område kunne tilgås lateralt fra tre sideportaler, hvor den centrale pore indeholdt flere konstruktioner. For eksempel, en konserveret lysinrest tæt på den cytoplasmatiske region af den indre helix, formentlig dannet chloridionselektivitetsfilteret. Kernestrukturen og samlingen lignede natriumkanalerne, der ikke er beslægtede i aminosyresekvensen, og derfor leder kationer i stedet for anioner. Sammen med elektrofysiologi gav de indsigt i ionledning og gating for en ny klasse af chloridkanaler, der arkitektonisk adskiller sig fra tidligere beskrevne chloridkanalfamilier.
Kloridionkanaler
Kloridioner er rigelige anioner i dyr, og de bevæger sig over cellemembraner via kloridkanaler og transportører til en række cellulære funktioner, herunder cellevolumenregulering, intracellulær forsuring og excitabilitetskontrol i muskler. Ionerne observeres i vid udstrækning i pattedyrsceller, selvom de molekylære komponenter bag chloridstrømmene indtil nu har været uhåndgribelige. To uafhængige undersøgelser, der brugte genom-dækkende RNA-interferensscreening, havde identificeret TMEM206 som den underliggende anionkanal. TMEM206 er evolutionært konserveret i hvirveldyr. Chloridkanaler er forskellige i både aminosyresekvens og tredimensionel arkitektur. I dette arbejde, Deng et al. præsenterede en kryo-elektronmikroskopi (cryo-EM) struktur af pufferfish TMEM206 for at afsløre en trimerisk kanalarkitektur, der er forskellig fra de tidligere kendte. Forskerne kombinerede elektrofysiologi med dette arbejde for at give den første strukturelle og funktionelle beskrivelse af en evolutionært konserveret og bredt udtrykt chloridkanal for at etablere en molekylær ramme og forstå chloridledning og kanalport.
Underenhedsstruktur og kanalsamling. (A) Struktur af en enkelt underenhed, viser det transmembrane domæne (rødt), indre β-domæne (blå), ydre β-domæne (orange), og HTH (grøn). Sekundære strukturelementer er angivet. (B) Trimerisk kanalsamling. To af underenhederne er vist i overfladerepræsentation. (C) Ortogonal visning som i (B), fra den ekstracellulære side. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.abe5983 
Forskerne brugte grønne fluorescerende proteinmærkede konstruktioner til at identificere TMEM206-kandidater og udvalgte pufferfish TMEM206 på grund af deres 50 procent fælles sekvensidentitet med den humane chloridkanal. Deng et al. oprensede derefter fuldlængde vildtype pufferfish TMEM206-proteinet og udsatte det for enkelt-partikel cryo-EM-analyse. Brug af 3D-rekonstruktionskort, de afslørede en trimer kanalarkitektur med transmembrane og ekstramembrane domæner. TMEM206 dannede en symmetrisk trimer, hvor hver underenhed indeholdt et transmembrandomæne (TMD) med to membranspændende helixer ved navn TM1 og TM2 og et stort ekstracellulært domæne (ECD) beriget med β-domæner med yderligere motiver yderligere organiseret i de øvre og nedre lag. Derudover omfattende sidekædekontakter var involveret gennem van der Waals-interaktioner i de indre og ydre-β-domæner. Den trimere kanalsamling indførte tre laterale åbninger eller sideportaler i midten af den ekstracellulære region for sandsynligvis at lette passagen af ion og vand. De aflange sideportaler strakte sig til ECD-TMD-krydset for at genoptage tæt pakningsinteraktion. For at overvinde eventuelle tekniske vanskeligheder med at bestemme strukturen af proteinet, Deng et al. fusionerede C-terminalen af knoglebegrænset interferon-induceret transmembranlignende protein (forkortet BRIL); et fire-helix bundt protein, der i vid udstrækning anvendes som en krystallisations-chaperon for at forbedre membranstabilitet og fremme krystaldannelse.
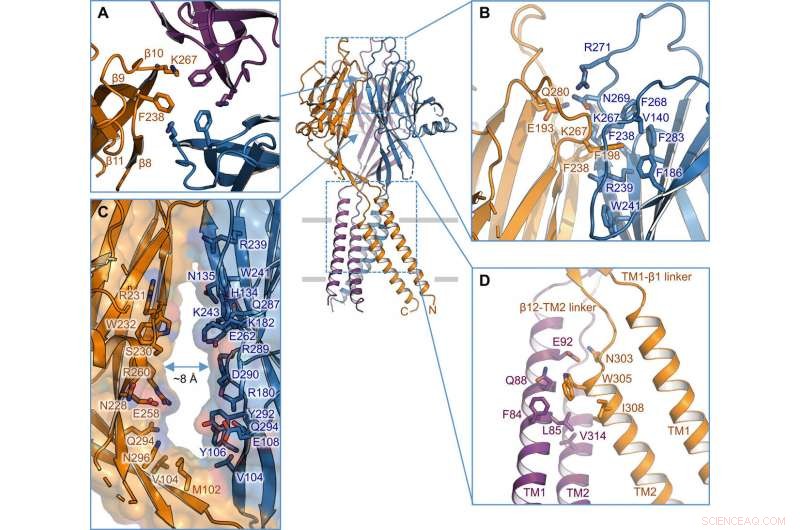
Intersubunit interface. (A) Trimerisk grænseflade ved spidsen af ECD. Sidekæder af K267 og F238 er fremhævet. (B) Set fra siden af intersubunit-grænsefladen på det øverste lag af ECD. Rester involveret i grænsefladen er vist i stick-repræsentation. (C) Sideportal i midten af ECD mellem to nabounderenheder. Overflade og rester på væggen er illustreret. (D) TM1-TM2 intersubunit interface. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.abe5983
Ionpermeationsvej og mutagenese undersøgelser
Ved hjælp af poreradiusberegninger, Deng et al. viste, hvordan den centrale ionledningspore indeholdt flere indsnævringer for at forhindre ionpassage. Strukturen repræsenterede ikke-ledende konformation på grund af de høje pH-bufferbetingelser (pH 8,0), der blev brugt til at bestemme kryo-EM-strukturen. Den voluminøse og aflange centrale vestibule kunne tilgås lateralt på grund af manglen på protein-protein-kontakter i det ekstracellulære domæne. Det smalle punkt af proteinkanalen interfererede ikke med ionledning og kunne opretholdes under kanalindgangscyklussen, når ioner passerede gennem de tre sideportaler. Det let positive elektrostatiske potentiale af de indvendige vægge i den centrale vestibule og sideindgange lettede også tiltrækningen af chloridioner. Ved det ekstracellulære domæne-transmembrane domæne (ECD-TMD) kryds, tre strenge forbundet til de ydre helixer og bevæget sig indad for at forbinde indre helixer for at generere en ekstracellulær gate over bilipidlaget. På hinanden følgende konstruktioner ved de porevendte positioner dannede en hydrofob port, som kunne forhindre ionledning.
For at understøtte de strukturelle resultater, Deng et al. udførte mutageneseundersøgelser på vigtige porelevende rester. Når de erstattede de konserverede basiske rester med alanin eller sure rester, de syreaktiverede kloridstrømme blev afskaffet. I modsætning, argininsubstitutioner bibeholdt kanalfunktion til yderligere at understøtte kravet om positive ladninger i det anionselektive filter. For eksempel, I310-domænet udgjorde en kritisk komponent i transmembranporten, og en anden struktur kendt som K320 dannede anionselektivitetsfilteret. Arbejdet understøttede strukturel konservering mellem menneske- og kuglefisk-ortologer for at repræsentere en fysiologisk relevant model for kloridkanaler.
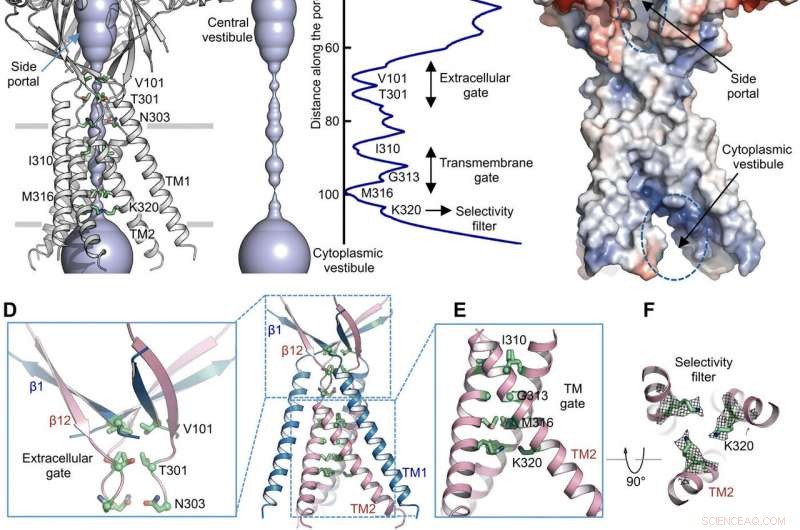
Ionpermeationsvej. (A) Struktur af TMEM206EM og den centrale ionledningspore, vist i overfladerepræsentation. Rester, der genererer forsnævringer, er fremhævet og mærket. Sideportalen er angivet. (B) Central ionledningspore og estimering af radius (højre panel). (C) Overfladerepræsentation af kanalen, farvet af overfladeelektrostatisk potentiale (rød, -5 kT/e; hvid, neutral; blå, +5 kT/e). Sideportalen og cytoplasmatisk vestibule er angivet. (D) Ekstracellulær gate ved ECD-TMD krydset. V101, T301, og N303 er vist i pindrepræsentation. (E) Transmembranport, udgøres af I310, G313, og M316. (F) Formodet selektivitetsfilter defineret af K320. Også vist er sidekædedensiteter for K320, kontureret ved 6,5 σ. (G og H) Strømtætheder med en ekstracellulær pH på 7,3 (G) og 4,6 (H) ved +100 mV for TMEM206-mutanter. Helcellemembranstrømmene blev registreret ved at bruge spændingsrampe fra -100 til +100 mV i 500 ms ved et holdepotentiale på 0 mV. (I) Forholdet mellem strømtæthed ved pH 4,6 til pH 7,3. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.abe5983
Strukturel konvergens
Topologien, struktur og samling af TMEM206 repræsenterede dem i epitelnatriumkanalen (ENaC)/degenerin superfamilien af ionkanaler, inklusive syre-sensing ion-kanaler (ASIC'er); på trods af en mangel på distinkt aminosyresekvenshomologi mellem de to kanaler. De trimere kanaler for modsat ladede natrium- og chloridioner, ikke desto mindre delte en fælles kernestruktur flankeret af to transmembrane helixer. Holdet bemærkede, hvordan den ekstracellulære port mellem den centrale vestibule og transmembranporen kunne udvides til at passere ioner igennem efter kanalaktivering. Mens epitheliale natriumkanaler kunne aktiveres ved at frigive hæmmende peptider gennem proteolyse i det ekstracellulære domæne, ASIC'erne og TMEM206 kunne kun aktiveres af ekstracellulære protoner. De bevarede strukturelle træk mellem TMEM og AS1CS foreslog også analoge gating-konformationelle ændringer for de to molekyler.
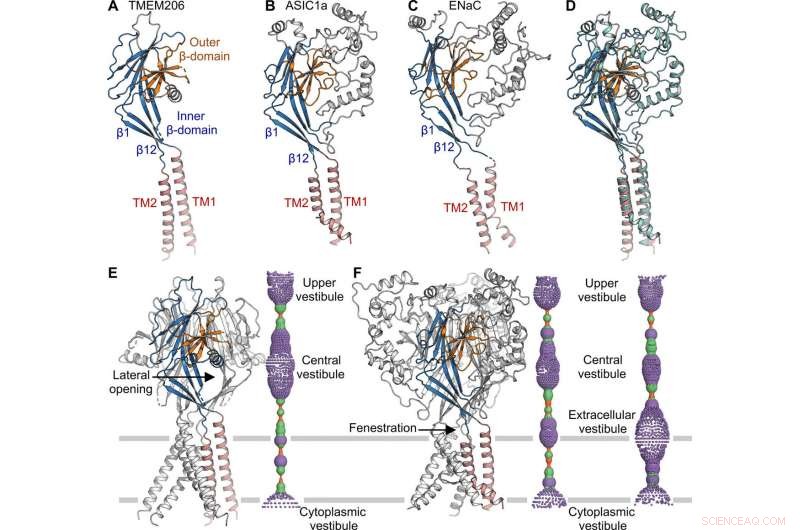
Strukturel sammenligning med ASIC og ENaC. (A til C) Underenhedsstrukturer af TMEM206 (A), ASIC1a [Protein Data Bank (PDB):6AVE] (B), og ENaC (PDB:6BQN) (C). Domæner har samme farve. (D) Superposition af TMEM206, farvet som i (A), og ASIC1a farvet i cyan. (E) Trimer TMEM206-kanal og dens centrale ionledningspore. Poren er estimeret ved hjælp af programmet HOLE og afbildet som farvede prikker (poreradius:rød <1,15 Å
Outlook
På denne måde Zengqin Deng og kolleger brugte enkelt-partikel kryo-EM til at bestemme strukturen af integrale membranproteiner, der typisk er uopnåelige ved hjælp af traditionel røntgenkrystallografi. Det er stadig en betydelig teknisk udfordring at opnå nær-atomisk opløsning for membranproteiner af lille størrelse på grund af lav kontrast og signal-til-støj-forhold. Deng et al. opnåede en 3,5 ångstrøm opløsningsstruktur af en kanal ved at fusionere en lille krystallisations-chaperone BRIL for at forbedre stabiliteten af de ellers suboptimale membranproteiner for at fremme krystalpakning. Baseret på den bevarede kernestruktur, kanalerne var selektive for enten kationer eller anioner og oplevede lignende gating-konformationelle ændringer. Arbejdet etablerede en ny klasse af chloridkanaler for at danne en ny ramme for yderligere funktionelle og mekaniske undersøgelser i celle- og strukturbiologi.
© 2021 Science X Network
 Varme artikler
Varme artikler
-
 Blæksprutte inspireret klæbemiddel fungerer under vandOctopus vulgaris. Billede:Wikipedia. (Phys.org) – Et team af forskere ved Sungkyunkwan University i Sydkorea har udviklet en type klæbeplaster, der fungerer under en række forskellige forhold, her
Blæksprutte inspireret klæbemiddel fungerer under vandOctopus vulgaris. Billede:Wikipedia. (Phys.org) – Et team af forskere ved Sungkyunkwan University i Sydkorea har udviklet en type klæbeplaster, der fungerer under en række forskellige forhold, her -
 Forskere analyserer de kemiske bindinger, der former proteinerIkke-kovalente interaktioner. Kredit:Kamran Makhmudov En international gruppe af forskere, herunder gæsteprofessor fra RUDN Universitet Kamran Makhmudov, har analyseret kemiske bindinger i protein
Forskere analyserer de kemiske bindinger, der former proteinerIkke-kovalente interaktioner. Kredit:Kamran Makhmudov En international gruppe af forskere, herunder gæsteprofessor fra RUDN Universitet Kamran Makhmudov, har analyseret kemiske bindinger i protein -
 Oprydning af olieudslipOlie i vand. Kredit:Stock billede, via Carnegie Mellon University, Institut for Kemiteknik Efter tusindvis af liter olie hældt ud i Stillehavet efter udslippet den 2. oktober, agenturer og frivill
Oprydning af olieudslipOlie i vand. Kredit:Stock billede, via Carnegie Mellon University, Institut for Kemiteknik Efter tusindvis af liter olie hældt ud i Stillehavet efter udslippet den 2. oktober, agenturer og frivill -
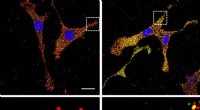 Billeddannelse af mRNA lige der, hvor det er lavet - på stedet for translationForskere bruger fluorescensprober til at overvåge stigninger i mRNA-ribosominteraktionsniveauer for et gen, der er forbundet med jernlagring som reaktion på jern (højre paneler). Målestok =20 μm. Kred
Billeddannelse af mRNA lige der, hvor det er lavet - på stedet for translationForskere bruger fluorescensprober til at overvåge stigninger i mRNA-ribosominteraktionsniveauer for et gen, der er forbundet med jernlagring som reaktion på jern (højre paneler). Målestok =20 μm. Kred
- Hvad bruges elektromagneter til i hverdagen?
- Her er 5 måder at flade klimaforandringskurven på, mens du sidder fast derhjemme
- Simuleringer af magnetisk indesluttede plasmaer afslører en selvregulerende stabiliseringsmekanisme
- Robotarme og midlertidig motorisering - den næste generation af kørestole
- For smuk til byggeri? Afdækning af kønsbias ved ansættelse til maskuline job
- Samarbejde mellem forskere og interessenter, der er afgørende for klimaberedskab i Alaska


