En mitokondri-målrettet fluorescerende sonde til cisplatin

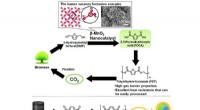
(a) Figur viser ændringen i den molekylære struktur af den mitokondri-målrettende sonde Rho-Mito i nærvær af lægemidlet cisplatin mod kræft. Dette får fluorescensen til at "tænde", muliggør organelspecifik overvågning af cisplatinakkumulering i celler. (b), til venstre) Figur viser real-time fluorescensbilleddannelse af cisplatinoptagelse i levende HeLa-celler med gennedslagning af COX17-protein. (b), til højre) Plot viser reducerede cisplatinniveauer og reduceret styrke af cisplatin i COX17-tømte celler. Kredit:Angewandte Chemie-International Edition
NUS-kemikere har udviklet en mitokondri-målrettet fluorescerende sonde til billeddannelse i realtid af klinisk vigtigt kræftmedicin cisplatin i levende kræftcellemodeller.
Siden opdagelsen i 1965, cisplatin er blevet et af de vigtigste kemoterapeutiske midler i klinisk brug. Det indgår i en klasse af platin (II) anticancer -midler og bruges i vid udstrækning til behandling af en række maligniteter, såsom testikler, æggestokkene, lungekræft og kolorektal kræft. På trods af cisplatins styrke og udbredt brug, der er fortsat betydelige huller i forståelsen af dets virkningsmekanisme. Det er generelt accepteret, at cisplatin virker ved at binde sig til genomisk deoxyribonukleinsyre (DNA) i kernen, som hæmmer ribonukleinsyre (RNA) transkription og inducerer cellulær apoptose. Imidlertid, andre cellulære komponenters rolle kan ikke udelukkes, især da mindre end 1% af cisplatin administreret resulterer i genomisk DNA-binding. Mitokondrier er tidligere blevet foreslået at være et vigtigt cellulært mål for cisplatin, fordi det indeholder unikt mitokondrielt DNA, adskilt fra dem, der findes i kernen.
Prof ANG Wee Han og hans forskerteam fra Institut for Kemi, National University of Singapore har udviklet en mitokondri-målrettet fluorescerende sonde kendt som Rho-Mito, der er i stand til at detektere tilstedeværelsen af cisplatin selektivt og med god præcision i mitokondrierne (se figur (a)). Den sædvanlige metode til kvantificering af cisplatin er at måle platinindholdet i kræftceller gennem elementær analyse. Det er en besværlig proces, der involverer isolering af mitokondrier og sur fordøjelse, hvilket reducerer eksperimentel præcision. På grund af dets destruktive karakter, denne metode kan kun udføres som en enkelt måling af tidspunkter. Det er ikke i stand til at levere kontinuerlige målinger i levende celler, hvilket er påkrævet, når man studerer platinakkumulering over tid. Med Rho-Mito, gruppen var i stand til at udføre realtidsovervågning af cisplatinoptagelse i mitokondrierne for første gang i levende celler ved hjælp af fluorescensmikroskopi (se figur (b)).
Brug af Rho-Mito i deres levende-celle fluorescens billeddannelseseksperimenter, gruppen opdagede, at cisplatinakkumulering i mitokondrier reduceres betydeligt efter gennedslagning af COX17, et protein, hvis primære rolle er at transportere kobber til mitokondrier. Bemærkelsesværdigt, fald i mitokondrielle cisplatinniveauer i COX17-tømte celler korreleret med en reduktion i den samlede styrke af cisplatin. En lignende tendens blev også observeret med andre platin (II) analoger. Gennem disse laboratorieforsøg, forskerne viser, at mitokondrier er en vigtig cellulær komponent målrettet af cisplatin og andre platin (II) forbindelser.
Prof Ang sagde, "Vi mener, at Rho-Mito er et nyttigt værktøj, der kan give forskere mulighed for bedre at forstå platinbaserede lægemidlers virkningsmekanisme og bane vejen for design af mere målrettede og effektive platinlægemidler."
Bevæger sig fremad, teamet planlægger at udvide biblioteket med målsonder til forskning om lokalisering af platinbaserede lægemidler i andre cellulære rum i kræftceller.
 Varme artikler
Varme artikler
-
 Forskere afdækker mekanismen for svampeluminescens og skaber selvlysende gærSelvlysende gær. Kredit:Sergey Shakhov Russiske forskere med kolleger fra Storbritannien, Spanien, Brasilien, Japan og Østrig har fuldt ud beskrevet mekanismen for svampeluminescens. De rapportere
Forskere afdækker mekanismen for svampeluminescens og skaber selvlysende gærSelvlysende gær. Kredit:Sergey Shakhov Russiske forskere med kolleger fra Storbritannien, Spanien, Brasilien, Japan og Østrig har fuldt ud beskrevet mekanismen for svampeluminescens. De rapportere -
 Forbrugere, quats og COVID-19:Er desinfektionsprodukter sikre?Kredit:CC0 Public Domain I lyset af en vedvarende global pandemi, desinfektionsmidler er vigtigere end nogensinde. Disse produkter er nogle gange afhængige af kvaternære ammoniumforbindelser, elle
Forbrugere, quats og COVID-19:Er desinfektionsprodukter sikre?Kredit:CC0 Public Domain I lyset af en vedvarende global pandemi, desinfektionsmidler er vigtigere end nogensinde. Disse produkter er nogle gange afhængige af kvaternære ammoniumforbindelser, elle -
 Grønne katalysatorer med jordrige metaller fremskynder produktionen af biobaseret plastUdskiftning af fossilbaseret PET, kendt som råmateriale til sodavandsflasker, med biobaseret PEF bidrager i høj grad til reduktion af CO 2 emissioner. Kredit:Keigo Kamata fra Tokyo Institute of Tech
Grønne katalysatorer med jordrige metaller fremskynder produktionen af biobaseret plastUdskiftning af fossilbaseret PET, kendt som råmateriale til sodavandsflasker, med biobaseret PEF bidrager i høj grad til reduktion af CO 2 emissioner. Kredit:Keigo Kamata fra Tokyo Institute of Tech -
 Proteinporer pakket i polymerer laver supereffektive filtreringsmembranerProteinporer fundet i cellemembraner blev med høj densitet inkorporeret i polymerplader, der blev stablet for at skabe højeffektive filtreringsmembraner. Kredit:Cockrell School of Engineering, Univers
Proteinporer pakket i polymerer laver supereffektive filtreringsmembranerProteinporer fundet i cellemembraner blev med høj densitet inkorporeret i polymerplader, der blev stablet for at skabe højeffektive filtreringsmembraner. Kredit:Cockrell School of Engineering, Univers
- Ukraines forskere navigerer lockdown for at nå Antarktis
- 2 kraftige jordskælv ryster det vestlige Indonesien; ingen tsunami
- Ny metal-halvleder-grænseflade til hjerneinspireret computing
- Skovbrand, Grillforbud:Hedebølgen brænder Europa
- Apple afholder begivenhed den 25. marts, tips til streaming
- Børns gener afslører potentiel skævhed i skoleligaen


