Nyt værktøj har til formål at bekæmpe COVID-19, andre sygdomme
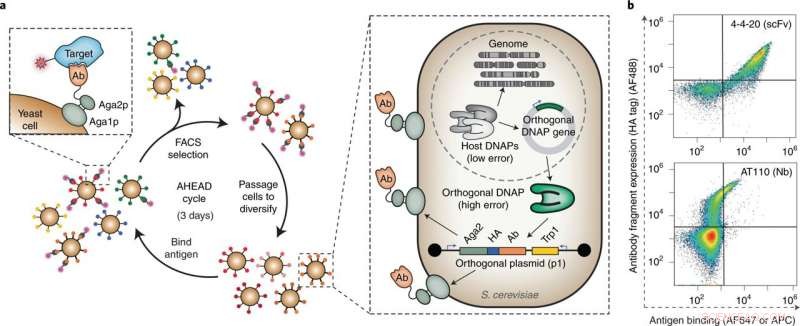
Fig. 1:Autonom hypermutation gæroverfladevisning (AHEAD). en, Skema for den hurtige udvikling af højaffinitetsbinding ved hjælp af AHEAD. Ab, antistoffragment; DNAP, DNA-polymerase; HA, hæmagglutinin tag. b, Cytometriplot, der viser påvisning af et funktionelt overfladevist enkeltkædet antistoffragment (scFv) og et funktionelt overfladevist nanostof (Nb) kodet på det p1 ortogonale plasmid, replikeres af et associeret ortogonalt DNAP. Den ortogonale DNAP, der blev brugt i dette tilfælde, var wt TP-DNAP1 (metoder) snarere end den fejltilbøjelige TP-DNAP1-4-2 variant, der blev brugt til alle efterfølgende AHEAD evolution eksperimenter. Beslægtede antigener for 4-4-20 (fluorescein) og AT110 (AT1R) blev mærket med biotin og FLAG tag, henholdsvis, og påvist med AF647-konjugeret streptavidin og allophycocyanin-konjugeret anti-FLAG, henholdsvis. HA-mærket blev påvist med muse-anti-HA og et gede-anti-mus AF488-konjugeret sekundært antistof. Fra:Hurtig generering af potente antistoffer ved autonom hypermutation i gær
Når skadelige bakterier eller vira kommer ind i kroppen, immunceller opdager afslørende proteiner kendt som antigener på angribernes overflader og sender hære af antistoffer ud for at afværge dem. Hvis nogle af disse antistoffer har den helt rigtige form, de kan låse på og blokere antigenerne som nøglen til en hængelås.
Men vores immunsystem har ikke altid de rigtige antistoffer til at bekæmpe en bestemt angriber. Så i løbet af de sidste par årtier har videnskabsmænd lært at arbejde med dyr som kameler og lamaer, og at bruge syntetiske designteknikker i laboratoriet, at danne antistoffer, der kan omdannes til medicin.
Mere end 85 antistofterapier er blevet godkendt af FDA til dato, inklusive to udstedte nødtilladelser til behandling af COVID-19.
På trods af deres succes, nuværende tilgange har ulemper. I et forsøg på at springe disse forhindringer, forskere ved Harvard Medical School og University of California, Irvine, har udviklet en hurtigere, enklere, og billigere adaptiv teknologi til at generere højt specialiserede antistoffer.
De har allerede brugt platformen, døbt AHEAD, at udvikle antistoffer mod den virus, der forårsager COVID-19. Andre grupper undersøger nu disse antistoffer som grundlag for diagnostiske tests og terapier.
"Vi tror på, at AHEAD vil være et stærkt værktøj til hurtigt at opdage og optimere antistoffer, især til behandling af hurtigt udviklende patogener, " sagde Andrew Kruse, professor i biologisk kemi og molekylær farmakologi ved Blavatnik Institute ved HMS og co-senior investigator af undersøgelsen sammen med Chang Liu ved UC Irvine.
Hurtigere opdagelse af antistoffer kan fremskynde lægemiddeludvikling, diagnostisk test, og grundlæggende videnskabelige eksperimenter.
Som rapporteret 24. juni i Naturens kemiske biologi , metoden bruger gær til at lave hundredvis af millioner af forskellige syntetiske antistoffragmenter kaldet nanobodies. Forskere kan droppe deres antigen af interesse - såsom spikeproteinet, som SARS-CoV-2 bruger til at trænge ind i og inficere menneskelige celler - i et hætteglas med gær og se, hvilke nanobodies der hænger fast.
Holdet konstruerede gæren, så nanobodies udvikler sig med hver generation. Det giver forskere mulighed for at vinde første runde, læg dem i et nyt hætteglas, og udføre en anden sortering for at få nanobodies, der låser sig på antigenet endnu mere vellykket. De kan køre yderligere runder, indtil de er tilfredse med, at de har en eller flere nanobodies, der binder godt, og binder kun, til det sygdomsfremkaldende antigen, maksimere chancen for at udvikle en terapi, der er effektiv og har minimale bivirkninger.
Hele processen bruger standard laboratoriegærkulturteknikker og tager kun halvanden til tre uger. Forskere kan jage efter nanobodies mod mange forskellige antigener på samme tid.
"Vi kan udvikle antistoffer med tidligere utilgængelig hastighed og skala, " sagde Kruse. "Det er en ny måde at lave kombinatorisk proteinteknologi på."
AHEAD er en forkortelse for Autonomous Hypermutation yEast SurfAce Display.
Arbejdet bygger på en tidligere platform ledet af Kruse og en kollega ved University of California, San Francisco. Den nye version adskiller sig i dens autonome udviklingsevner, som efterligner den måde, antistoffer naturligt udvikler sig på i lamaer og kameler.
"Det er spændende at bringe denne kraftfulde immunproces i dyr til gærceller, " sagde Conor McMahon, co-første forfatter af papiret med Alon Wellner i Liu laboratoriet. McMahon udførte arbejdet, mens han var postdoc i Kruse-laboratoriet. Han er nu Vertex Fellow hos Vertex Pharmaceuticals.
Pandemipotentiale
Mens AHEAD har potentialet til at producere antistoffer mod trusler såsom cancer og proteiner involveret i autoimmune tilstande, Kruse og kolleger er i øjeblikket fokuseret på at bruge teknologien til at bekæmpe COVID-19.
"Vi ønskede at få dette projekt i gang så hurtigt som vi kunne, sagde Kruse, "og vi håber, at vi nu kan handle endnu hurtigere, hvis noget som denne pandemi skulle ske igen."
Da forskerne introducerede SARS-CoV-2-antigener i gærhætteglassene, de afslørede nanobodies, der neutraliserede dem mindst lige så godt som, og i nogle tilfælde bedre end, eksisterende antistoffer genereret fra humane patienter, dyr, og laboratorieforsøg.
Nanoboderne havde varierende succes med at overbevise antigenerne til at binde sig til dem i stedet for til ACE2-receptoren, som SARS-CoV-2 bruger til at trænge ind i menneskelige celler.
Nogle kolleger, der gik videre med de mest lovende nanobody-kandidater, er begyndt at se lignende resultater i dyremodeller, mens andre bruger nanobodies til at forsøge at udvikle bedre værktøjer til at opdage SARS-CoV-2 og relaterede coronavirus, ifølge Kruse og medforfattere.
AHEAD kan også hjælpe eksperter med at reagere hurtigere, når nye SARS-CoV-2-varianter eller helt nye patogener opstår.
"Hvis SARS-CoV-2 udvikler sig på en måde, der undslipper nuværende antistofterapier til nødbrug, vi burde være i stand til at udvikle nye om cirka to uger for at blokere flugtvarianterne, sagde Kruse.
Da "næsten ethvert biologisk laboratorium" er udstyret til at bruge det enkle udstyr og teknikker, AHEAD skulle give mange grupper mulighed for at arbejde på at finde løsninger på fremtidige udbrud "i et distribueret svar, der imødekommer problemets presserende karakter, " tilføjede Kruse.
Debora Marks' laboratorier, assisterende professor i systembiologi ved HMS, og Jonathan Abraham, assisterende professor i mikrobiologi ved HMS, bidraget til arbejdet. Holdet udgav et relateret papir i Naturkommunikation detaljerede de nye beregningsteknikker, de udviklede for at muliggøre AHEAD.
 Varme artikler
Varme artikler
-
 Forskere skaber en ny elektronegativitetsskalaKredit:Pixabay/CC0 Public Domain Skoltech-kemikere har foreslået en ny elektronegativitetsskala og offentliggjort deres resultater i Naturkommunikation . Begrebet elektronegativitet introducere
Forskere skaber en ny elektronegativitetsskalaKredit:Pixabay/CC0 Public Domain Skoltech-kemikere har foreslået en ny elektronegativitetsskala og offentliggjort deres resultater i Naturkommunikation . Begrebet elektronegativitet introducere -
 Forskere dekonstruerer gammelt jødisk pergament ved hjælp af flere billedbehandlingsteknikkerUV-fluorescensundersøgelse. Kredit:Forfatterne Et billede kan sige mere end tusind ord, men at fange flere billeder af en artefakt på tværs af det elektromagnetiske spektrum kan fortælle en rig hi
Forskere dekonstruerer gammelt jødisk pergament ved hjælp af flere billedbehandlingsteknikkerUV-fluorescensundersøgelse. Kredit:Forfatterne Et billede kan sige mere end tusind ord, men at fange flere billeder af en artefakt på tværs af det elektromagnetiske spektrum kan fortælle en rig hi -
 Forskere udvikler nye gennemsigtige bredbånds elektromagnetiske interferensafskærmningsmaterialerFig. Prøverne af gennemsigtige EMI -afskærmningsmaterialer fremstillet gennem (a) et laboratoriefacilitet og (b) et pilotanlæg. Kredit:NIMTE Den fleksible optoelektroniske materialegruppe ledet af
Forskere udvikler nye gennemsigtige bredbånds elektromagnetiske interferensafskærmningsmaterialerFig. Prøverne af gennemsigtige EMI -afskærmningsmaterialer fremstillet gennem (a) et laboratoriefacilitet og (b) et pilotanlæg. Kredit:NIMTE Den fleksible optoelektroniske materialegruppe ledet af -
 Forskere forbedrer metode, der forbinder genomet til at fungere for miljømæssige enkeltcellerProceduren for Raman-aktiveret celleudstødning og sekventering (RACE-Seq). Kredit:SU Xiaolu Celler er lidt nemmere at forstå, takket være forbedret teknologi udviklet af et team af forskere basere
Forskere forbedrer metode, der forbinder genomet til at fungere for miljømæssige enkeltcellerProceduren for Raman-aktiveret celleudstødning og sekventering (RACE-Seq). Kredit:SU Xiaolu Celler er lidt nemmere at forstå, takket være forbedret teknologi udviklet af et team af forskere basere
- Større Yellowstone -område forventes at blive varmere, tørrere
- Økosystemer i hele Australien kollapser under klimaforandringer
- Astronomer observerer nova V659 Sct under udbrud
- Ny undersøgelse besvarer gamle spørgsmål om, hvorfor tropiske skove er så økologiske forskellig…
- Forskere bruger kunstig intelligens til at se indvendige stjerner ved hjælp af lydbølger
- Et stort skridt mod den praktiske anvendelse af 3-D holografi med højtydende computere


