Forskere skaber en ny elektronegativitetsskala

Kredit:Pixabay/CC0 Public Domain
Skoltech-kemikere har foreslået en ny elektronegativitetsskala og offentliggjort deres resultater i Naturkommunikation .
Begrebet elektronegativitet introduceret i 1930'erne af Linus Pauling, en stor amerikansk kemiker, refererer til et atoms evne til at tiltrække elektrontæthed. I en kemisk binding, det mere elektronegative atom får ekstra elektroner, bliver negativt ladet, mens den mindre elektronegative mister elektroner og bliver positivt ladet. Elektronegativitet er afgørende for at forklare ting, der spænder fra energien af kemiske bindinger til (in)stabiliteten af kemiske forbindelser og farven og hårdheden af krystaller.
Siden da, kemikere er kommet med forskellige definitioner og skalaer for elektronegativitet. Alligevel er Paulings skala den første og den mest almindelige, findes i enhver lærebog i kemi. Pauling udledte sine elektronegativitetsværdier fra termokemi ved hjælp af energierne fra nogle kemiske bindinger. Han foreslog den enkleste formel til at beregne en bindings stabilisering på grund af forskellen i elektronegativitet mellem atomerne. Det viste sig senere, at forudsigelserne med Paulings skala havde en ret lav nøjagtighed.
Skoltech-professor Artem R. Oganov og forsker Christian Tantardini vovede at ændre Paulings formel og omdefinere elementernes elektronegativiteter og endte med at skabe en ny skala af elektronegativitet.
"Det hele startede, da vi besluttede at beregne Paulings elektronegativiteter under tryk. Kemien ved højtryk er ret eksotisk. Alligevel, du vil sandsynligvis være i stand til at forstå en masse ting, når du finder ud af, hvordan elementernes elektronegativitet ændrer sig under pres. Vi brugte Paulings definition til at beregne elektronegativitet under normale forhold. Vi var forbløffede over at opdage, at hans skala ikke matchede hverken teoretiske eller eksperimentelle bindingsenergier for signifikant ioniske molekyler. I øvrigt, mange publikationer i kemisk litteratur nævner denne inkonsekvens, men ingen tilbyder en konsekvent løsning. Jeg indså, at grundårsagen var, at Pauling behandlede molekylets ioniske stabilisering som en additiv effekt. Hvis vi betragter det som en multiplikationseffekt, mange ulemper vil blive fjernet. Med den nye formel og eksperimentelle energier af kemiske bindinger, vi bestemte elektronegativiteten af alle grundstofferne. Vi fik en smuk skala, der virker både til små og store forskelle i elektronegativitet, " forklarer professor Oganov.
Den nye skala bruger elektronegativitet som en dimensionsløs størrelse, hvilket er meget praktisk og nøjagtigt gengiver både molekylers energier og kemiske reaktioner.
 Varme artikler
Varme artikler
-
 Den første præcise måling af et enkelt molekyls effektive ladningForskere kan bestemme den effektive elektriske ladning af et molekyle ved at fange det i en potentiel brønd ved at måle, hvor længe det bliver inde. Kredit:Madhavi Krishnan / University of Zurich
Den første præcise måling af et enkelt molekyls effektive ladningForskere kan bestemme den effektive elektriske ladning af et molekyle ved at fange det i en potentiel brønd ved at måle, hvor længe det bliver inde. Kredit:Madhavi Krishnan / University of Zurich -
 Fiskeaffald som råmateriale til industrivarerForskere Revilija Mozuraityte og Rasa Slizyte i SINTEF-laboratoriet, hvor de analyserer olier, gelatine, og smagsneutrale proteiner afledt af de resterende råvarer efter laksefiletering. Kredit:Håvard
Fiskeaffald som råmateriale til industrivarerForskere Revilija Mozuraityte og Rasa Slizyte i SINTEF-laboratoriet, hvor de analyserer olier, gelatine, og smagsneutrale proteiner afledt af de resterende råvarer efter laksefiletering. Kredit:Håvard -
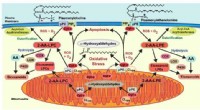 Hvad sker der med plasmalogener, fosfolipiderne ingen kan lide at tænke påDiagram viser signalveje påvirket af cytochrom cs nedbrydning af plasmalogen. Kredit:Richard Gross Patienter med Alzheimers sygdom mister op til 60 % af en komponent kaldet plasmalogen fra membran
Hvad sker der med plasmalogener, fosfolipiderne ingen kan lide at tænke påDiagram viser signalveje påvirket af cytochrom cs nedbrydning af plasmalogen. Kredit:Richard Gross Patienter med Alzheimers sygdom mister op til 60 % af en komponent kaldet plasmalogen fra membran -
 Kemikere lærer computerprogram til at modellere kræfter mellem atomer nøjagtigtKredit:MIPT Et team af forskere fra MIPT, Skoltech, og Dukhov Research Institute of Automatics, ledet af Artem Oganov, brugte en machine learning -teknik til at modellere opførslen af aluminium
Kemikere lærer computerprogram til at modellere kræfter mellem atomer nøjagtigtKredit:MIPT Et team af forskere fra MIPT, Skoltech, og Dukhov Research Institute of Automatics, ledet af Artem Oganov, brugte en machine learning -teknik til at modellere opførslen af aluminium
- Hvad er forskellen mellem blå og rød lakmapapir?
- Ny forskning for at give sikrere og mere præcise vejrudsigter i rummet
- Partners økonomi påvirker trivsel, selv i ung kærlighed:studie
- Er det tid til at bevæge sig ud over grænserne for byggemiljøtænkning?
- Bærbare sensorer efterligner hud for at hjælpe med sårhelingsprocessen
- Smarte vinduer kunne også kombinere solpaneler og fjernsyn


