Nyt enzym nedbryder affald til billigere biobrændstoffer, bioprodukter
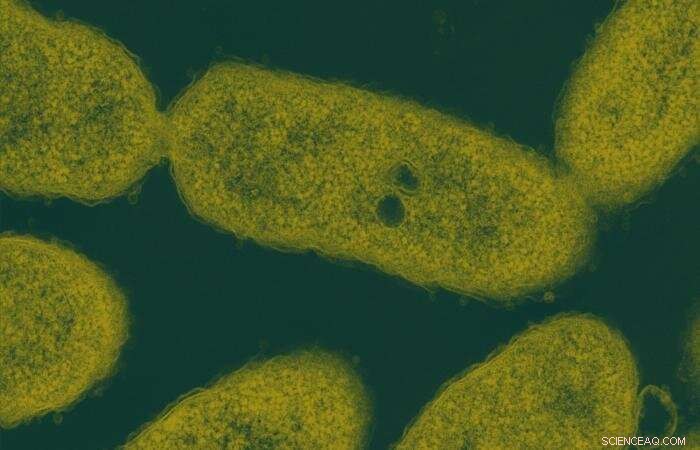
Forskere opdagede enzymet, ved navn LsdE, i bakterien Novosphingobium aromaticivorans, afbilledet, en mikrobe af interesse i ligninvalorisering. Kredit:Delyana Vasileva og Andy Sproles, ORNL/U.S. Afd. for Energi; John Dunlap, University of Tennessee
I et skridt hen imod at øge omkostningseffektiviteten af vedvarende biobrændstoffer og bioprodukter, forskere ved Oak Ridge National Laboratory opdagede et mikrobielt enzym, der nedbryder svære at bryde bindinger i lignin, et affaldsprodukt fra bioraffinaderier.
Når det indsættes i en biomanipuleret bakterie, enzymet hjælper effektivt med at omdanne ligninforbindelser til en fælles komponent i plastik, åbne en vej til at omdanne affald til et kommercielt værdifuldt biokemikalie.
"Lignin er en virkelig kompliceret polymer, " sagde Josh Michener, der ledede ORNL's forskning som beskrevet i detaljer Metabolisk teknik . Polymeren, som bidrager til planternes strukturelle stivhed, består af nyttige monomerenheder holdt sammen af svage og stærke bindinger. Med lignin, der udgør 20 til 30 vægtprocent af plantebiomassen, at bryde polymerens stærke bindinger og omdanne de kemikalier, de binder sammen, til værdiskabende produkter er nødvendigt for at gøre produktionen af plantebaserede biobrændstoffer og produkter økonomisk rentabel.
Forskellige samfund af bakterier og svampe udfører disse processer i naturen, men det kan være vanskeligt at opretholde en blanding af så mange forskellige mikrober i én bioreaktor. For at løse dette problem, ORNL-forskere i Center for Bioenergy Innovation, eller CBI, ønsker at identificere de enzymer, som mikrober bruger til at nedbryde specifikke bindinger i lignin og konstruere de gener, der koder for disse enzymer, til en enkelt organisme.
arbejder hen imod dette mål, ORNL-forskere målrettede en særlig genstridig binding, der forbinder to kulstofmolekyler i en lignin-dimer - en enhed af to sammenføjede monomerer - kaldet 1, 2-diguaiacylpropan-1, 3-diol, eller DGPD.
Holdet brugte bakterien Novosphingobium aromaticivorans, en mikrobe af interesse i ligninvalorisering. Efter at have identificeret og dyrket en mutant N. aromaticivorans-stamme, der effektivt nedbrød den ønskede binding i DGPD, forskerne brugte bakteriel genetik og genforstyrrelsesteknikker til at finde ud af, hvilket enzym der var ansvarligt.
Til deres overraskelse, enzymet de identificerede - som de kaldte LsdE - var blevet mærket som et hypotetisk protein, hvilket betyder, at dens funktion var ukendt.
"Ingen havde set denne form for kemi før, " sagde Michener. "Der var ingen eksempler i litteraturen på et enkelt enzym, der kunne udføre denne særlige transformation."
Opdagelsen blev muliggjort af ORNL-holdets tilgang i genomskala. Biologiske teknikker er ofte afhængige af homologi, en metode til at undersøge enzymer, der ligner dem med kendte funktioner. Imidlertid, Michener bemærkede, "Når vi leder efter et hypotetisk protein, der aldrig er blevet beskrevet, vi kan ikke finde det ved homologi."
I stedet, holdet brugte genetiske teknikker, der gjorde det muligt for dem at finde leads ved at se bredt på tværs af N. aromaticivorans-genomet. De konstruerede derefter et sæt mutante mikrober, hver med et enkelt gen forstyrret. I fællesskab hvert ikke-essentielt gen blev forstyrret i mindst én af disse mutanter.
Hvis mutantmikroben mistede sin evne til at nedbryde DGPD-dimeren, når et bestemt gen blev fjernet, forskerne kunne fastslå, at enzymet kodet af det gen var ansvarligt for nedbrydningen, uden at skulle kende dens funktion på forhånd.
"I dette tilfælde, der var ingen grund til, at vi nogensinde ville se på LsdE og sige, at dette enzym åbenbart gør den reaktion, " sagde Michener. "Det var en af de mest spændende dele - og det faktum, at vi har metoder på plads til at gøre den slags opdagelser."
I en anden mikrobe, nye muligheder
Efter at have identificeret LsdE, ORNL-teamet testede for at se, om de kunne validere dets funktion yderligere. Deres test bekræftede LsdE's rolle og afslørede, at et bedre kendt enzym, LsdA, spillet en komplementær rolle i yderligere at nedbryde DGPD til nyttige forbindelser.
På National Renewable Energy Laboratory, en projektpartner i CBI, videnskabsmænd indsatte begge enzymer i en stamme af bakterien Pseudomonas putida, der allerede var blevet konstrueret til at producere muconsyre, en værditilvækst forløber for plast. De fandt ud af, at tilsætning af enzymerne gjorde det muligt for P. putida at omdanne DGPD til muconsyre med et næsten 100 % udbytte.
"Med mange produkter, du mister kulstof undervejs, " sagde Allison Werner, en postdoc-forsker ved NREL og medforfatter på undersøgelsen. "Men i dette tilfælde, vi har en meget effektiv vej."
"Til det bedste af vores analytiske evner, hvert molekyle af dimeren, som vi startede med, blev omdannet til to molekyler af produktet, hvilket er ret fænomenalt, " sagde Michener.
Dette arbejde er en del af en større indsats for at omdanne lignin til værdiskabende produkter. Fremtidig forskning vil sigte mod at opdage nye enzymer, der nedbryder andre hårde bindinger og for bedre at forstå den kemiske struktur af LsdE.
 Varme artikler
Varme artikler
-
 Genmanipuleret gær opsuger tungmetalforureningKredit:American Council on Science and Health Miljøforurening med tungmetaller er ofte resultatet af forskellige typer industrielle processer. Fordi tungmetaller kan være farlige for mennesker og
Genmanipuleret gær opsuger tungmetalforureningKredit:American Council on Science and Health Miljøforurening med tungmetaller er ofte resultatet af forskellige typer industrielle processer. Fordi tungmetaller kan være farlige for mennesker og -
 Magnetiske nanopartikler trækker værdifulde elementer fra vandkilderPotentielle lithiumkilder fra vand produceret i minedrift og petroleumsdrift, udtrykt som koncentration (parts per million). Data fra US Geological Survey, Produceret vanddatabase. Kredit:Pacific Nort
Magnetiske nanopartikler trækker værdifulde elementer fra vandkilderPotentielle lithiumkilder fra vand produceret i minedrift og petroleumsdrift, udtrykt som koncentration (parts per million). Data fra US Geological Survey, Produceret vanddatabase. Kredit:Pacific Nort -
 Første detaljerede kig på afgørende enzym fremmer kræftforskningenPetra Fromme er direktør for Biodesign Center for Applied Structural Discovery. Hun er også Regents Professor ved ASUs School of Molecular Sciences. Kredit:Biodesign Institute ved Arizona State Univer
Første detaljerede kig på afgørende enzym fremmer kræftforskningenPetra Fromme er direktør for Biodesign Center for Applied Structural Discovery. Hun er også Regents Professor ved ASUs School of Molecular Sciences. Kredit:Biodesign Institute ved Arizona State Univer -
 Chokolade, te eller kaffe med zink kan reducere oxidativ stressKredit:CC0 Public Domain Aldring og lav levealder er forårsaget, i hvert fald delvist, ved oxidativ stress. Et team af forskere ledet af prof. Dr. Ivana Ivanovi-Burmazovi fra formanden for bio-org
Chokolade, te eller kaffe med zink kan reducere oxidativ stressKredit:CC0 Public Domain Aldring og lav levealder er forårsaget, i hvert fald delvist, ved oxidativ stress. Et team af forskere ledet af prof. Dr. Ivana Ivanovi-Burmazovi fra formanden for bio-org
- Nintendos online gaming netværk tilbage efter større udfald
- Hjælp kaldenavnet New Horizons næste flyby-mål
- Universitetsstuderende udvikler kunstig intelligens til at registrere hurtige radioudbrud
- Motiverende aktiviteter til at undervise Integers
- En virtuel platform til dataadgang, analyse og publicering er med til at forme Blue Growth
- NASA finder, at tørken i Amazon efterlader lang arv efter skader


