Hvordan ved et reguleringsprotein, hvor det skal bindes for at modulere insulinproduktionen?
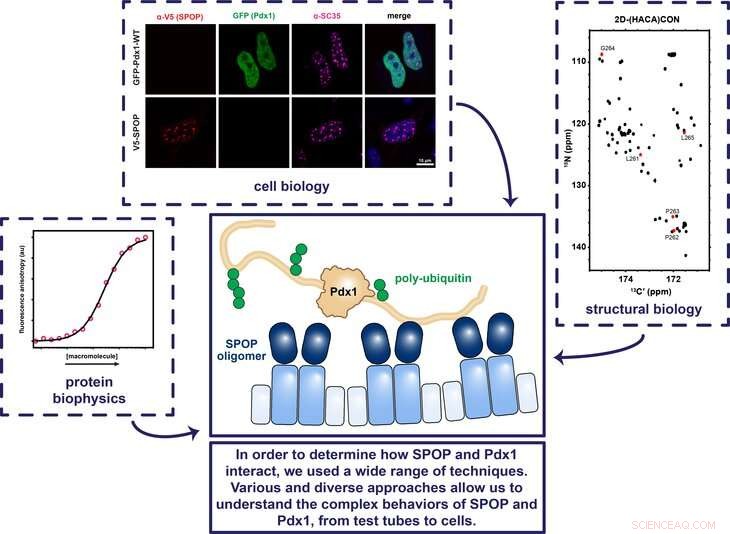
Penn State -forskere brugte en række forskellige teknikker vedrørende cellebiologi, strukturel biologi, og proteinbiofysik for at bestemme, hvordan proteinerne SPOP og Pdx1 fungerer sammen for at sikre, at genet, der koder for insulin, tændes og slukkes på det korrekte tidspunkt. Kredit:Showalter Lab, Penn State
Nogle proteiner i kroppen sikrer, at gener tændes og slukkes på de korrekte tidspunkter. For eksempel, transkriptionsfaktorproteinet Pdx1 (pancreas og duodenal homeobox 1) tænder det gen, der koder for insulin, og proteinet SPOP (specielt type POZ-protein) binder sig til gengæld til Pdx1, så kroppen ikke laver for meget insulin. Men det er uklart, hvordan SPOP binder sig til Pdx1. At forstå, hvor SPOP binder, kan hjælpe forskere med at forudsige, hvad der disponerer individer for at udvikle diabetes og tydeliggøre, hvordan SPOP regulerer andre vigtige proteiner. I en nylig undersøgelse, et team af forskere fra Penn State og St. Jude Children's Research Hospital afbildede proteinerne og bestemte, hvordan denne vigtige interaktion opstår.
Et papir, der beskriver interaktionen, blev for nylig offentliggjort i Journal of Biological Chemistry . Vi talte med to af forfatterne til papiret, Scott Showalter, professor i kemi og biokemi og molekylærbiologi, og Emery Usher, kandidatstuderende i biokemi, Mikrobiologi og molekylærbiologi (BMMB) program, om dette arbejde.
Sp:Hvorfor er Pdx1 vigtig for menneskekroppen, og hvordan understøtter SPOP dets funktion?
Showalter:Pdx1 er en transkriptionsfaktor, som er et protein, der binder til DNA'et i dit genom og styrer, om gener i nærheden vil blive tændt eller slukket. Hos mennesker, Pdx1 findes primært i bugspytkirtlen, hvor det tænder det gen, der koder for proteininsulinet, når der er brug for mere af det. Når der opbevares nok insulin til fremtiden, SPOP binder til Pdx1 og får det til at blive ødelagt af genbrugsmaskiner til cellulære proteiner, dermed slukker insulinproduktionen.
Usher:I sidste ende, Pdx1 og SPOP arbejder sammen om at opretholde glukosehomeostase; det er, den omhyggelige balance mellem glukoseniveauer i cellerne og i blodbanen. Især SPOP udfører en lignende regulerende rolle for snesevis af andre proteiner i masser af forskellige celletyper, som alle er kritiske for passende cellefunktion.
Sp:Hvad var din motivation for denne undersøgelse?
Showalter:Selvom vi vidste, at Pdx1 og SPOP arbejder sammen om at regulere det insulin-kodende gen, forud for denne undersøgelse var detaljerne i denne interaktion uklare. Det var kendt fra andet arbejde, at SPOP slukker proteiner ved at vedhæfte et molekylært signal til dem, der retter sig mod disse proteiner til destruktion, men Pdx1 ligner ikke andre proteiner, som SPOP regulerer. Næsten alle proteiner, der vides at være reguleret af SPOP, har flere genkendelsessekvenser, eller sekvenser af aminosyrer, der fungerer som et kodeord. Imidlertid, Pdx1 indeholder ikke nogen af de sekvenser, som SPOP var kendt for at binde til. Mit laboratorium har investeret en stor indsats i løbet af det sidste årti for at udvikle teknikker, der kan bruges til at karakterisere interaktioner som dem, som vi vidste skal eksistere mellem Pdx1 og SPOP. I dette studie, vi satte os for at bestemme, hvor SPOP binder til Pdx1, og hvordan den ved, at den har fundet det eller de rigtige websteder.
Usher:SPOP kan faktisk genkende mere end en af disse aminosyre -password -sekvenser og kan dermed målrette mod mange partnere, så det er svært at lave en omfattende liste over de aminosyresekvenser, som SPOP leder efter. Undersøgelse af interaktionen mellem Pdx1 og SPOP kan også give indsigt i andre proteiner, som SPOP kan binde sig til.
Sp .:Hvad var de vigtigste resultater af denne undersøgelse?
Showalter:Vi var meget glade for at opdage, at der ikke kun er et SPOP -bindingssted på Pdx1, men to. Det vides, at SPOP generelt binder flere steder i de proteiner, det kontrollerer, så dette resultat var meget tilfredsstillende, fordi det bringer Pdx1 -regulering i overensstemmelse med samfundets mere generelle forståelse af, hvordan SPOP fungerer. Efter at vi fandt det andet bindingssted, vi brugte røntgenkrystallografi til at forestille det kompleks, der dannes, når SPOP er bundet til Pdx1 på disse nyopdagede bindingssteder. Denne struktur afslørede, at selvom en usædvanlig sekvens af aminosyrer i Pdx1 var involveret i SPOP -binding, de geometriske og kemiske detaljer lignede faktisk meget tidligere fastlagte strukturer. Vores resultater tyder på, at den tidligere definition af et SPOP -bindingssted var for snæver.
Usher:Vi har nu en bedre forståelse af de kemiske regler, der definerer, om en sekvens er en god kandidat til at binde eller ej. Vores struktur foreslår også en sandsynlig mekanisme til at forstyrre Pdx1 -binding af SPOP, når denne interaktion er uønsket - f.eks. når Pdx1 er nødvendig for at producere mere insulin.
Sp .:Hvorfor er disse fund vigtige?
Showalter:Det er vigtigt at forstå de molekylære detaljer i biologiske processer som glukoseafhængig insulinproduktion og hvordan de reguleres, fordi det er de afgørende faktorer mellem normal sundhed og sygdom. At forstå de sekvenser, som SPOP binder sig til, hjælper os med at forudsige, hvorfor visse genetiske variationer kan disponere individer og familier, der fører dem til at udvikle diabetes. Tilsvarende ved at præcisere de regler, som SPOP bruger til at identificere de proteiner, det skal binde til og regulere, vi kan bedre forudsige andre proteiner, det regulerer. Vi kan også være i stand til at forudsige, hvordan naturligt forekommende variationer i deres aminosyresekvenser kan forstyrre normal SPOP -binding, fører til dårlige sundhedsresultater.
Usher:SPOP er også kendt for sin rolle i visse kræftformer, herunder prostata- og endometriecancer. Selvom det er uden for omfanget af vores nuværende arbejde, bedre at definere, hvordan SPOP vælger bindende partnere, vil sandsynligvis også påvirke fremtidig forskning på dette område.
Sidste artikelOsmiumaktivering i kræftceller
Næste artikelGør gærceller til laboratorier til undersøgelse af drivere for genregulering
 Varme artikler
Varme artikler
-
 Metal forenkler syntesen af antistoflægemidlerRice University-kemikere har designet et plug-in metalloprotein for at forenkle opgaven med at lave målrettede antistofterapier. Forskerne brugte et tredobbeltmetaliseret peptid (indsat) til at give e
Metal forenkler syntesen af antistoflægemidlerRice University-kemikere har designet et plug-in metalloprotein for at forenkle opgaven med at lave målrettede antistofterapier. Forskerne brugte et tredobbeltmetaliseret peptid (indsat) til at give e -
 Vandoverflademolekyler mister energi ved rotation af den frie OH -gruppeFigur 1:I modsætning til andre vandmolekyler (røde kugler:oxygenatomer; hvide kugler:brintatomer), dem på overfladen har en fri hydroxylgruppe (OH). Tahei Tahara og hans team har brugt ultrahurtig spe
Vandoverflademolekyler mister energi ved rotation af den frie OH -gruppeFigur 1:I modsætning til andre vandmolekyler (røde kugler:oxygenatomer; hvide kugler:brintatomer), dem på overfladen har en fri hydroxylgruppe (OH). Tahei Tahara og hans team har brugt ultrahurtig spe -
 Fremtidige hærkøretøjer kunne se en forbedring af strukturelle materialerHærens forskere ser på nye konstruktionsmaterialer til ubemandede køretøjssystemer, såsom RQ-7B Shadow vist her, fordi disse materialer er mindre modtagelige for korrosion, lette og har højere elektri
Fremtidige hærkøretøjer kunne se en forbedring af strukturelle materialerHærens forskere ser på nye konstruktionsmaterialer til ubemandede køretøjssystemer, såsom RQ-7B Shadow vist her, fordi disse materialer er mindre modtagelige for korrosion, lette og har højere elektri -
 Tværfagligt samarbejde fører til katalysatorer, der er op til 50 gange mere effektiveKemiske reaktioner forekommer på overfladen af bimetalliske nanopartikler. Forskere fandt ud af, at arrangering af de to metaller i et kerneskalledesign gør disse katalysatorer op til 50 gange mere
Tværfagligt samarbejde fører til katalysatorer, der er op til 50 gange mere effektiveKemiske reaktioner forekommer på overfladen af bimetalliske nanopartikler. Forskere fandt ud af, at arrangering af de to metaller i et kerneskalledesign gør disse katalysatorer op til 50 gange mere
- Fra toilet til teglværk:Genanvendelse af biosolider for at lave bæredygtige mursten
- Motoriseret rulle kunne masseproducere grafen-baserede enheder
- En vanskelig reaktionssekvens får et stort løft fra et flow-opsætning og statistik
- Kemiske og fysiske egenskaber ved stål
- OSIRIS-REx tager et nærmere billede af Jupiter
- Ældre, tættere kvarterer giver bedre adgang til hverdagens destinationer, undersøgelse finder


