Forskning belyser den tidligste del af faseadskillelsen
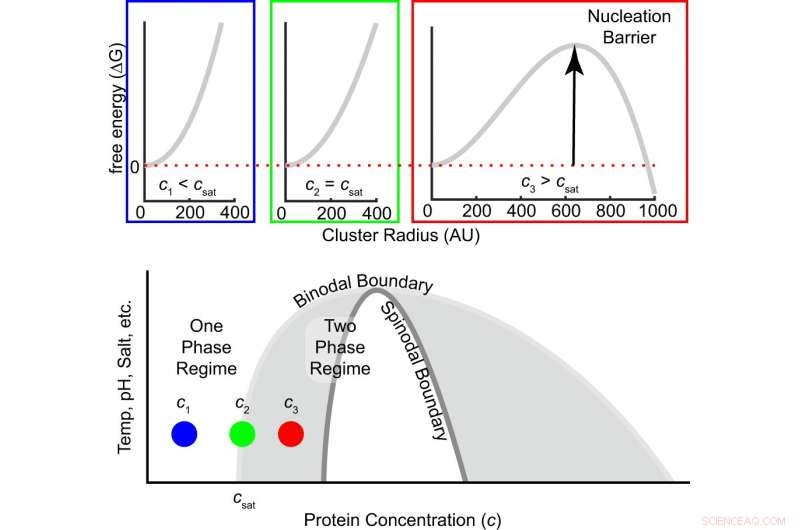
Fig. 1:Den frie energibarriere for kernedannelse afhænger af graden af overmætning. Den frie energi som funktion af klyngestørrelse er vist øverst for tre koncentrationer, dvs. under, ved og over mætningskoncentrationen. Når koncentrationen stiger fra undermættet til mætningskoncentrationen til overmættet, tegnet på den frie energiforskel mellem et molekyle i og uden for en klynge skifter fra positiv til negativ, og en endelig kernedannelsesbarriere fremkommer (Eq. (1)). Det grå område inde i binodalen er metastabilt, hvilket betyder, at kernedannelse er påkrævet for at danne tætte faseklynger, der vokser, indtil ligevægt er nået. Det hvide regime inde i spinodal er ustabilt, hvilket betyder, at opløsningen spontant nedbrydes i fortyndede og tætte faser. Kredit:DOI:10.1038/s41467-021-24727-z
Forskere ved St. Jude Children's Research Hospital studerer væske-væskefaseseparation (LLPS), en biofysisk proces, hvorigennem proteiner og nukleinsyrer i en celle opdeles uden en membran. Værket giver ny indsigt i, hvordan styrken af de kræfter, der driver faseadskillelsen, hænger sammen med den hastighed, hvormed den opstår. Resultaterne blev offentliggjort i dag i Naturkommunikation .
Celler skal sortere og organisere proteiner og andre komponenter. En måde de gør det på er gennem LLPS, en proces, der ligner den måde, olie danner dråber på i vand. Membranløse organeller, kroppe i en celle, der opfører sig som væskedråber, organisere visse proteiner uden at omslutte dem med en membran. I stedet, proteinerne holdes sammen af de biofysiske kræfter, der driver LLPS.
Man ved kun lidt om, hvordan biomolekyler går fra en enfaset opløsning til en tofaset blanding, i en proces kaldet kernedannelse. Denne proces har været udfordrende at evaluere, fordi den kræver at se på ekstremt hurtige tidsskalaer (mikrosekunder til millisekunder). Som resultat, de fleste undersøgelser har i stedet set på evolution inden for systemer, der allerede er i tofaset regime (hvordan dråber smelter sammen og vokser).
"Vi kan se på disse meget tidlige tidspunkter, at selv individuelle forstyrrede proteinmolekyler, der faseadskiller, har helt andre egenskaber end uordnede proteiner, der ikke faseadskiller, " sagde medkorresponderende forfatter Tanja Mittag, Ph.D., St. Jude Institut for Strukturel Biologi.
Forskning ved St. Jude og andre steder har vist, at LLPS kan være involveret i neurodegenerative sygdomme som amyotrofisk lateral sklerose (ALS) og cancer. En bedre forståelse af LLPS kan i sidste ende føre til muligheder for terapeutisk at målrette dele af processen.
Mikrosekundtidsmålinger giver ny forståelse
Den fremherskende opfattelse af LLPS i biologi har været, at en ændring i cellulære forhold spontant kan føre til kernedannelse, at skifte en enfaset løsning til to faser. I denne forskning, forskerne brugte et forenklet system, med et enkelt protein i vand og salt, at undersøge, om skiftet faktisk skete på en sådan måde, eller om der kræves yderligere trin for at kickstarte processen.
Med en teknik kaldet hurtig blanding, tidsbestemt, småvinklet røntgenspredning (TR-SAXS), forskerne var i stand til at observere de tidligste stadier af processen. De undersøgte kernedannelsen af et prionlignende domæne kaldet A1-LCD fra proteinet hnRNPA1. Mutationer af dette protein forårsager ALS og andre sygdomme.
Forskerne viste, hvordan klynger af A1-LCD dannes, og hvordan disse klynger fører til LLPS. Resultaterne indikerer, at nukleering indeholder forskellige trin, differentieret efter klyngens størrelse. Når man ser på de mindste klynger (med få individuelle molekyler), videnskabsmænd fandt ud af, at samlingsadfærden adskilte sig fra klassisk kernedannelsesteori. Disse afvigelser forklarer potentielt, hvorfor faseadskillelse af nogle biomolekyler kan ske på millisekunder, mens det tager timer for andre.
"Selv i et forenklet system, du skal stadig tage højde for denne form for ikke-ideelle effekter i de tidlige stadier af kernedannelse, " sagde medkorrespondent forfatter Erik Martin, Ph.D., St. Jude Institut for Strukturel Biologi. "Før du kan begynde at tænke på faseadskillelsessamling eller kondensering i celler, du skal tænke på tingene fra et molekylært niveau. Der vil være indledende trin til denne samling, der ikke er taget højde for i tidligere modeller."
 Varme artikler
Varme artikler
-
 Hvordan en manetformet struktur lindrer trykket i dine cellerDen nye undersøgelse, offentliggjort for nylig i tidsskriftet eLife , viser, at SWELL1 er lavet af seks underenheder, der mødes på toppen, bundter sammen for at danne en manetlignende kappe med seks
Hvordan en manetformet struktur lindrer trykket i dine cellerDen nye undersøgelse, offentliggjort for nylig i tidsskriftet eLife , viser, at SWELL1 er lavet af seks underenheder, der mødes på toppen, bundter sammen for at danne en manetlignende kappe med seks -
 Sådan beregnes procentdissociationNår stærke syrer anbringes i vand, adskiller de sig fuldstændigt. Det vil sige, at al syre (HA) adskilles i protoner (H +) og deres ledsagende anioner (A¯). I modsætning hertil adskiller svage syre
Sådan beregnes procentdissociationNår stærke syrer anbringes i vand, adskiller de sig fuldstændigt. Det vil sige, at al syre (HA) adskilles i protoner (H +) og deres ledsagende anioner (A¯). I modsætning hertil adskiller svage syre -
 Overraskende opdagelse kan ændre den måde, industrien bruger nikkel påSEM-billede af korroderet nikkel på overfladen. Kredit:Mengying Liu Nikkel er et af de mest udbredte grundstoffer på jorden. Det er svært, dog formbar, magnetisk ved stuetemperatur, og en relativt
Overraskende opdagelse kan ændre den måde, industrien bruger nikkel påSEM-billede af korroderet nikkel på overfladen. Kredit:Mengying Liu Nikkel er et af de mest udbredte grundstoffer på jorden. Det er svært, dog formbar, magnetisk ved stuetemperatur, og en relativt -
 Design af en fritstående, superladet polypeptid-proton-ledende membranDC_E108. Kredit:Science Advances, doi:10.1126/sciadv.abc0810 Protoner er subatomære partikler med en positiv elektrisk ladning. Proton -translokation spiller en væsentlig rolle i naturfænomener og
Design af en fritstående, superladet polypeptid-proton-ledende membranDC_E108. Kredit:Science Advances, doi:10.1126/sciadv.abc0810 Protoner er subatomære partikler med en positiv elektrisk ladning. Proton -translokation spiller en væsentlig rolle i naturfænomener og
- Forskere observerer kavitationens rolle i glasbrud
- Britiske lovgivere anbefaler skrappere regler på Facebook
- Fremskridt inden for superopløselig mikroskopi
- Ekstra 100 millioner år før Jorden oplevede permanent iltstigning
- Hærens nye fund sænker utilsigtet detonation af lagre
- Sådan fisker du efter crayfish & crawdads i Oregon


