Hvordan en manetformet struktur lindrer trykket i dine celler
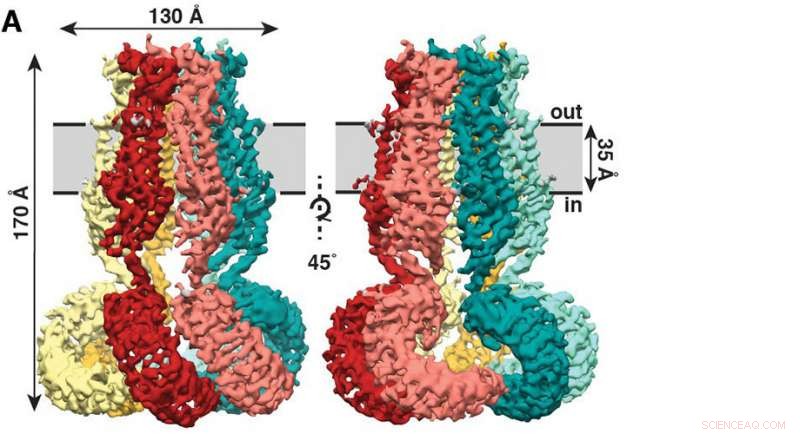
Den nye undersøgelse, offentliggjort for nylig i tidsskriftet eLife , viser, at SWELL1 er lavet af seks underenheder, der mødes på toppen, bundter sammen for at danne en manetlignende kappe med seks stængler hængende ned. Kredit:Kefauver et al. Scripps Research
Forskere ved Scripps Research har løst strukturen af et nøgleprotein, der registrerer, når vores celler svulmer. Dette protein, kaldet SWELL1 (eller LRRC8A), fungerer som en "ionkanal" på cellemembranen for at aflaste trykket inde i cellerne.
Den nye undersøgelse, offentliggjort for nylig i tidsskriftet eLife , viser, at SWELL1 er lavet af seks underenheder, der mødes på toppen, bundter sammen for at danne en manetlignende kappe med seks stængler hængende ned.
"Denne struktur giver et første indblik i, hvordan denne ionkanal registrerer ændringer i volumen i en celle, "siger Jennifer Kefauver, kandidatstuderende på Scripps Research, Howard Hughes Medical Institute, og første forfatter til den nye undersøgelse.
SWELL1 blev opdaget i 2014 i laboratoriet hos Ardem Patapoutian, Ph.d., professor ved Scripps Research og efterforsker ved Howard Hughes Medical Institute. Opdagelsen åbnede døren til afgørende undersøgelser af, hvordan proteinet fungerer.
Det næste vigtige trin var at kaste lys over SWELL1s molekylære struktur. Forskerne havde til formål at forstå det grundlæggende i, hvordan denne ionkanal registrerer ændringer i volumen. At gøre dette, de havde brug for at tage et kig på kanalens molekylære maskineri.
Kefauver stod i spidsen for studier som en fælles studerende mellem laboratorierne i Patapoutian og Andrew Ward, Ph.d., professor ved Scripps Research og leder i en billedteknik i høj opløsning kaldet kryo-elektronmikroskopi (kryo-EM). Kefauver brugte cryo-EM teknikker til at løse SWELL1s manetlignende struktur og få et første kig på, hvordan ioner kan rejse gennem kanalens centrale pore. "Jennifer forfulgte strukturen i SWELL1 med stor ihærdighed, lad ingen sten stå og overvinde utallige forhindringer. Det var vidunderligt at se frugterne af hendes arbejde resultere i en så smuk struktur, "sagde Ward.
Dette nye blik på ionkanalen antyder, at interagerende dele af tendrils-steder, der har en positiv eller negativ ladning, fornemmer en ændring i ionstyrken i cellen (en fortynding af cellens saltindhold, når den absorberer vand). De ladede rester kunne sende et signal op til kanalens pore, fortæller kanalen at frigive chloridioner fra cellen og lindre trykket.
Kefauver håber, at dette nye syn på strukturen kan give næring til medicinsk forskning. SWELL1 har en rolle i mindst én sygdom-en immunmangel kaldet agammaglobulinæmi. "At have strukturen er virkelig vigtig for forskere, der prøver at forstå, hvordan denne kanal fungerer, og hvad sygdomsfremkaldende mutationer kan gøre."
Næste, forskerne kiggede nærmere på, hvordan de forskellige dele af SWELL1 -strukturen påvirker kanalfunktionen. De fandt ud af, at mutation af proteinet på et af to steder forhindrer strukturen i at kontrollere trafikken gennem ionkanalen korrekt.
Den nye undersøgelse viser bundter af SWELL1-underenheden alene-og forskere ved, at SWELL1 skal være der for en funktionel kanal. Men op til fire andre underenheder kan bytte ind i strukturen på forskellige steder. Kefauver siger, at det næste trin er at bestemme, hvordan forskellige kombinationer af SWELL1 -underenheder kommer sammen for at danne ionkanaler med forskellige aktiviteter.
 Varme artikler
Varme artikler
-
 Giv den plasmabehandlingen:Stærk vedhæftning uden klæbemidlerFotografi af tre-lags samlinger af (a) PTFE/PDMS/Cu, (b) PTFE/PDMS/SUS430, og (c) PTFE/PDMS/glas. Når PTFE- eller PDMS-arket blev rykket og rystet, der forekom ingen afskalning ved grænsefladerne på P
Giv den plasmabehandlingen:Stærk vedhæftning uden klæbemidlerFotografi af tre-lags samlinger af (a) PTFE/PDMS/Cu, (b) PTFE/PDMS/SUS430, og (c) PTFE/PDMS/glas. Når PTFE- eller PDMS-arket blev rykket og rystet, der forekom ingen afskalning ved grænsefladerne på P -
 En hurtigere og mere pålidelig metode til at kategorisere olivenolie er valideretKlassificering af olivenolier i kategorierne ekstra jomfru (EVOO), virgin (VOO) og lampante (LOO) er stadig noget af en udfordring at håndtere, da den officielle metode omfatter fysisk-kemiske og sens
En hurtigere og mere pålidelig metode til at kategorisere olivenolie er valideretKlassificering af olivenolier i kategorierne ekstra jomfru (EVOO), virgin (VOO) og lampante (LOO) er stadig noget af en udfordring at håndtere, da den officielle metode omfatter fysisk-kemiske og sens -
 Ny inkjet-udskrivningsmetode kunne fremskynde opdagelse af lægemidler og trykt personlig lægemidde…Tomme porer synlige i en polymerfilm, hvor dråber blev trykt, fanget og frigivet. Kredit:University of Cambridge Cambridge-ingeniører har demonstreret - for første gang - den digitale inkjet-print
Ny inkjet-udskrivningsmetode kunne fremskynde opdagelse af lægemidler og trykt personlig lægemidde…Tomme porer synlige i en polymerfilm, hvor dråber blev trykt, fanget og frigivet. Kredit:University of Cambridge Cambridge-ingeniører har demonstreret - for første gang - den digitale inkjet-print -
 Dette røde lys betyder, at gå efter medicinske opdagelserUVA’s Hui-wang Ai, Ph.d., og Shen Zhang, Ph.d., har udviklet en enkel og effektiv forbedring af fluorescerende biosensorer, der er meget udbredt inden for videnskabelig og medicinsk forskning. Kredit:
Dette røde lys betyder, at gå efter medicinske opdagelserUVA’s Hui-wang Ai, Ph.d., og Shen Zhang, Ph.d., har udviklet en enkel og effektiv forbedring af fluorescerende biosensorer, der er meget udbredt inden for videnskabelig og medicinsk forskning. Kredit:
- En alsidig, ren og effektiv måde at forbedre udbredt anvendelse af carbon nanorør
- Overraskende kemisk kompleksitet af Saturns ringe skiftende planeter øvre atmosfære
- Klimakrise udløser en stigning i antallet af dødsfald ved lynnedslag i Indien
- Efterhånden som Digital Earth tager fart, Kina sætter tempoet
- Forskere opdager, hvad en pansret dinosaur spiste til sit sidste måltid
- 3D-print og nanoteknologi, en mægtig alliance for at opdage giftige væsker


