Fra atomet til naturlig dræbercelle:Historien om en uventet proteinstruktur

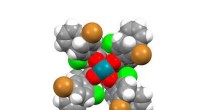
Struktur af human NKR-P1, der viser den unikke dimeriseringsgrænseflade. Panel (a) sammenligner krystalstrukturer af NKR-P1-receptorbindende domæne-dimerer. Panel (b) viser en strukturel sammenligning af LLT1 (grøn) og NKR-P1 (cyan) dimerer fremstillet ved kun at overlappe én monomer fra hver dimer (midten). Selvom de begge deler en lignende struktur, er deres dimeriseringstilstand det modsatte. Kredit:Charles University
Opdagelsen af en ejendommelig proteinstruktur og søgen efter at bekræfte den har ført til beskrivelsen af interagerende receptorklynger på naturlige dræberceller (NK). Undersøgelsen udført af forskerholdet af Dr. Ondřej Vaněk fra Institut for Biokemi, Det Naturvidenskabelige Fakultet, Charles University og hans kolleger fra Institut for Bioteknologi ved Det Tjekkiske Videnskabsakademi i centret BIOCEV blev for nylig offentliggjort i tidsskriftet Naturkommunikation .
Laboratory of Structural Biochemistry of Immune Recognition, ledet af Dr. Ondřej Vaněk, producerede en spændende historie. Det hele startede for et par år siden med at observere en uventet proteinstruktur af en receptor og endte med en detaljeret beskrivelse af specifikke strukturer og interaktioner i immunsystemet.
"Vi er interesserede i, hvordan immunsystemets celler genkender, om andre celler i vores krop er sunde eller usunde," forklarer Dr. Vaněk. Hans forskerhold fokuserer primært på NK-celler, som er en del af medfødt immunitet, og hvis de fornemmer, at en anden celle i kroppen ikke er sund, kan de hurtigt fjerne det. Strukturel immunologi søger her at opdage, hvordan receptorer på overfladen af immunceller genkender proteiner (eller andre strukturer) på overfladen af en anden celle. "Disse proteiner fortæller NK-cellen, om alt er godt eller ej. Det, der ender med at ske, er ikke kun interaktionen mellem to proteiner, men det er samspillet mellem en række interaktioner, og i sidste ende vil enten et hæmmende eller et aktiverende signal sejre, " forklarer Dr. Vaněk.
Den netop offentliggjorte undersøgelse fokuserer på to proteiner og deres interaktion. En af dem er en receptor på NK-celler, kaldet NKR-P1. Denne receptor er interessant, fordi den tjener som en af de vigtigste overflademarkører, hvormed NK-celler kan defineres, selvom dens struktur har været ukendt indtil nu. NKR-P1-receptoren findes også på overfladen af nogle specifikke subpopulationer af T-lymfocytter, som er impliceret i adskillige autoimmune sygdomme. I denne sammenhæng er dens virkning dog endnu ikke velkarakteriseret, idet den sandsynligvis skifter fra rent hæmmende til costimulerende og dermed bidrager til udviklingen af disse sygdomme.
Det andet protein, undersøgelsen fokuserer på, er liganden af NKR-P1-receptoren, proteinet kaldet LLT1. Dette protein findes normalt på andre celler i immunsystemet, og som Dr. Vaněk beskriver:"Når celler interagerer og rører hinandens overflade, får det dem til at sige, at de kender til hinanden, og alt er fint." De sidste femten års forskning har dog vist, at LLT1-proteinet i mange tilfælde af kræft udtrykkes på overfladen af kræftceller, hvor det tjener til at hæmme immunresponset. Dr. Vaněk tilføjer:"Desværre, jo værre tumortypen er, jo højere overfladeekspression af LLT1-protein." Han og hans kolleger var de første til at beskrive strukturen af LLT1 i 2015.
Dette papir beskriver de to proteiner og deres interaktion på mange niveauer, fra atomstrukturen til celleniveau. Forskerholdet producerede først proteinerne, krystalliserede dem og løste strukturen af deres kompleks.
"Resultatet var ret uventet og interessant. Man spekulerer i det øjeblik, om dette blot er en artefakt af krystallen, eller om en sådan struktur virkelig eksisterer på celleoverfladen," bemærker Dr. Vaněk. Det næste ret komplekse trin i forskningen var superopløsningsmikroskopi, og de følgende faser af undersøgelsen blev udført på celleoverfladen og levende NK-celler isoleret fra donorblod. Ved at kombinere flere metoder bekræftede forskerholdet tidligere observationer i krystalstrukturen af komplekset af begge proteiner og beskrev de resulterende funktionelle konsekvenser - under hvilke betingelser NKR-P1- og LLT1-proteinerne skal opfylde for at producere et hæmmende signal.
Både NKR-P1-receptoren og dens ligand LLT1 er homodimerer, dvs. de danner altid par af to identiske kæder på celleoverfladen, forbundet med disulfidbindinger. Hidtil har tanken været, at når de to proteiner interagerer, binder en dimer af receptoren en dimer af liganden. Men takket være krystalstrukturen af NKR-P1-komplekset med LLT1 ved vi, at dette ikke er sandt:Halvdelen af receptordimeren interagerer med halvdelen af liganddimeren, hvilket tillader dannelsen af bindende klynger af disse molekyler på overfladen af NK-cellen, når den interagerer med målcellen.
Det tog flere års forskning at teste denne hypotese fra atom- til celleniveau. Affiniteten af de undersøgte proteiner er meget svag, og det er kun gennem clustering, at den bliver stærk nok til, at NK-cellen kan mærke det hæmmende signal. Nødvendigheden af, at flere molekyler mødes, er således en slags evolutionær beskyttelse mod unødvendige eller falske stimuli, og takket være det nye studie kan vi se præcis, hvordan denne interaktion fungerer på det strukturelle niveau. Dette kan hjælpe med at designe terapeutiske proteiner, der ønskeligt kunne påvirke interaktionen mellem immunsystemet og kræftceller.
Undersøgelsen blev udført af Dr. Ondřej Vaněks team ved Det Naturvidenskabelige Fakultet ved Charles University i samarbejde med teamet af Dr. Jan Dohnálek fra Institut for Bioteknologi ved Det Tjekkiske Videnskabsakademi (BIOCEV), som primært var involveret i strukturelle analyser. To forskere fra University of Oxford bidrog også væsentligt til forskningen, idet de udførte krystallisations- og røntgendiffraktionsmålinger.
"Flere generationer af studerende fra vores laboratorium har været involveret i denne undersøgelse, og førsteforfatteren, Jan Bláha, lavede sin ph.d.-grad om denne forskning. Efterhånden lærte vi flere og flere metoder, og de studerende avancerede meget. Nogle af dem arbejder nu på nogle af de bedste europæiske forskningsinstitutter," forklarer Dr. Vaněk.
Jan Bláha, den første forfatter til undersøgelsen og nu postdoc ved EMBL Hamburg, siger:"Det mest interessante for mig, mens jeg arbejdede på dette projekt, var at opdage ny indsigt i relativt almindelige data, der førte os til mere komplekse eksperimenter. Jeg lærte ikke at være bange for at følge mine egne skøre ideer, så længe de er baseret på data. Jeg har forstået, at mange af verdens eksperter kun er mennesker, og de mest lidenskabelige er legesyge og villige til at hjælpe med enhver skør videnskabelig ide." + Udforsk yderligere
Immunsystem:Første billede af antigenbundet T-cellereceptor ved atomopløsning
Sidste artikelUndersøgelse af forviklingerne i nitrogenkredsløbet
Næste artikelFisk kan hjælpe med at søge efter sklerosemedicin
 Varme artikler
Varme artikler
-
 Nye syntesemetoder forbedrer 3-D kemisk plads til lægemiddelopdagelseGrafisk viser den udviklede dirhodium-katalysator, der bruges til at syntetisere et 3D-stillads af stor interesse for den farmaceutiske industri. Davies-laboratoriet har udgivet en række store artikle
Nye syntesemetoder forbedrer 3-D kemisk plads til lægemiddelopdagelseGrafisk viser den udviklede dirhodium-katalysator, der bruges til at syntetisere et 3D-stillads af stor interesse for den farmaceutiske industri. Davies-laboratoriet har udgivet en række store artikle -
 Kemiker udvikler 3D-simuleringer af proteiner til spike i coronavirusAnimation, der viser, hvordan coronavirus -spike -protein ændrer form lige før det bindes til human celleceptor. Kredit:Illustration leveret af Mahmoud Moradi. Beregningskemiker Mahmoud Moradi vil
Kemiker udvikler 3D-simuleringer af proteiner til spike i coronavirusAnimation, der viser, hvordan coronavirus -spike -protein ændrer form lige før det bindes til human celleceptor. Kredit:Illustration leveret af Mahmoud Moradi. Beregningskemiker Mahmoud Moradi vil -
 Rejeskaller til fremstilling af elektroder til store batterierDe spanske forskeres forslag er at producere vanadium flow batterielektroder fra kitin, et materiale fra rejeskaller. Kredit:John Cameron / Unsplash Et projekt af spanske forskere og andre samarbe
Rejeskaller til fremstilling af elektroder til store batterierDe spanske forskeres forslag er at producere vanadium flow batterielektroder fra kitin, et materiale fra rejeskaller. Kredit:John Cameron / Unsplash Et projekt af spanske forskere og andre samarbe -
 Ny tilgang foreslår vej til emissionsfri cementI en demonstration af de grundlæggende kemiske reaktioner, der blev brugt i den nye proces, elektrolyse finder sted i neutralt vand. Farvestoffer viser, hvordan syre (pink) og base (lilla) produceres
Ny tilgang foreslår vej til emissionsfri cementI en demonstration af de grundlæggende kemiske reaktioner, der blev brugt i den nye proces, elektrolyse finder sted i neutralt vand. Farvestoffer viser, hvordan syre (pink) og base (lilla) produceres
- Study bringer nye klimamodeller af den lille stjerne TRAPPIST 1s syv spændende verdener
- Moderne computerkraft kan hjælpe med at afbøde fremtidige oversvømmelseskatastrofer
- Nytænkning af transkriptionsfaktorer og genekspression
- Høj risiko for virksomhedskonkurs på grund af coronavirus-pandemien, ifølge en ny analyse
- USA kan nå op på 90 % ren energi i 2035 uden højere omkostninger, siger rapporten
- Sådan identificerer du edderkopper i Connecticut


