Tæt og gennemtrængelig:Molekylær organisering af tight junctions afkodet
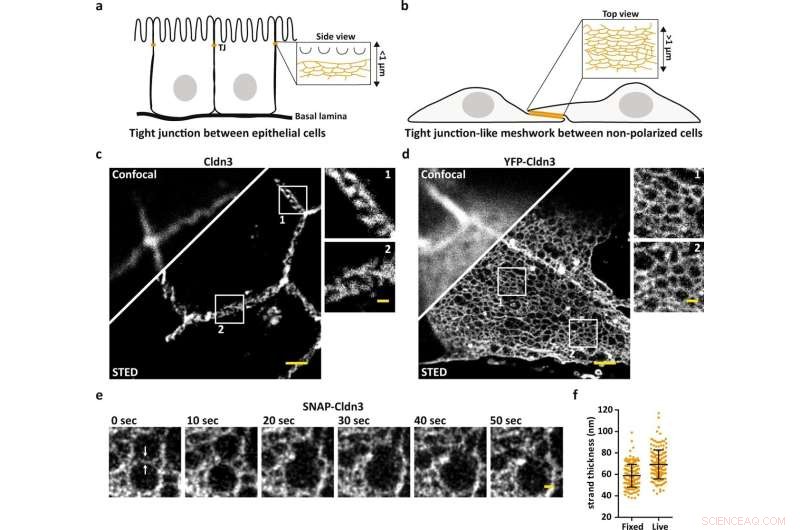
STED-mikroskopi afslører organisationen af TJ meshworks i nanoskala. et skema, der illustrerer den endogene TJ ved den mest apikale celle-til-celle kontakt i epitelceller. b Skema, der illustrerer TJ-lignende meshwork dannet i flade overlappende områder af claudin-transficerede ikke-polariserede celler. c, d Repræsentativt konfokalt og STED-billede af en endogen dannet TJ mærket for Cldn3 (2nd-Atto647N) mellem epitelceller fra væv fra muse duodenum (c) og TJ-lignende meshwork dannet af overudtrykt YFP-Cldn3 (α-GFP-NB- Atto647N) mellem to COS-7-celler (d). e Repræsentativ ensfarvet STED-tidsserie (1 ramme/10 s) af et TJ-lignende meshwork i en overlappende region af levende COS-7-celler, der udtrykker SNAP-Cldn3 (BG-JF646). Hvide pile angiver det indledende strengbrud efterfulgt af sammensmeltningen af to mindre masker til et større maske. En Gaussisk sløring med en sigma på 20 nm blev påført. f Fuld-wide-half-maximum (FWHM) måling af TJ-strenge af SNAP-Cldn3 (BG-JF646) i fikserede og levende COS-7-celler. Data repræsenterer middel ± SD. Hvert datapunkt repræsenterer en linjeprofil af i alt 160 linjeprofiler fra 8 uafhængige TJ-lignende meshworks (n = 160). Den samlede FWHM resulterede i 59 ± 11 nm for faste og i 69 ± 14 nm for levende prøver. Alle repræsentative billeder stammer fra 3 uafhængige eksperimenter. Skala søjler, 1 µm (c, d) og 200 nm (forstørrelser i c, d og e). Kredit:Nature Communications (2022). DOI:10.1038/s41467-022-32533-4
De forsegler epitelceller og tillader under visse forhold passage af ioner og vand:Tight junctions danner en paracellulær barriere i væv, og deres dysfunktion er forbundet med sygdomme. Selvom deres molekylære komponenter har været kendt siden 1990'erne, er det ikke tydeligt, hvordan de 26 proteiner kaldet claudiner er organiseret.
Forskere fra Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) har nu fået dyb indsigt i strukturen af tight junctions ved hjælp af super-resolution stimulated emission depletion (STED) mikroskopi. Det er første gang, at den grundlæggende mekanisme, der ligger til grund for alle epitelbarriereegenskaber, er blevet beskrevet.
Tight junctions (TJ) er normalt fremragende til at muliggøre passage af nødvendige ioner eller molekyler, mens de danner en tæt barriere for at forhindre uønskede bakterier og deres toksiner i at trænge ind i kroppen. Disse paracellulære barrierer, som samtidigt kan være selektive ion- og vandkanaler, findes overalt, hvor epitelceller eller endotelceller mødes, dvs. hvor forskellige væv er forbundet med hinanden, eller når et organs lumen skal forsegles fra blodstrømmen.
Eksistensen af tight junctions blev opdaget for omkring 60 år siden, og deres vigtigste molekylære komponenter har været kendt i 30 år:26 membranproteiner kaldet claudiner. Afhængigt af cellen er claudins organiseret i forskellige konstellationer for at danne semipermeable meshworks op til flere hundrede nanometer brede. Normalt kommer flere claudiner sammen, men nogle barrierer består af kun et eller to strukturelle proteiner.
Men spørgsmålet er, hvordan er claudins organiseret for at skabe forskellige barriereegenskaber afhængigt af den pågældende celle eller væv? Og i hvor høj grad er claudins afhængige af hinanden i processen? Indtil nu har disse spørgsmål været ubesvarede, fordi det var umuligt at gennemskue strukturen af strenge, som kun er omkring ti nanometer tykke. Nu er det lykkedes forskere fra FMP at gøre netop det ved hjælp af STED-mikroskopi.
"Denne type superopløsningsmikroskopi og et fremragende hold af cellebiologer, dataloger og fysiologer har hjulpet os med at kaste lys over den molekylære arkitektur af tætte krydsninger," sagde Dr. Martin Lehmann, leder af Cellular Imaging Group, sidste forfatter til Studiet. "Vi har nu for første gang været i stand til at beskrive den mekanisme, der ligger til grund for de vigtigste epitelbarriereegenskaber."
Brug af STED til at løse enkelte meshworks
Normalt er opløsningen af fluorescensmikroskoper begrænset til omkring 250 nanometer. Ved brug af STED-mikroskopi er 50 nanometer eller mindre muligt. Dette gav bogstaveligt talt forskerne større indsigt.
"Med standard fluorescensmikroskopi ville vi aldrig have trængt ind i den tætte organisation af den tætte forbindelse, men STED har gjort det muligt for os at løse de individuelle masker i netværket. Som et resultat er vi nu i stand til at bestemme den nøjagtige position af proteiner, som f.eks. samt at se, om claudins blander sig eller adskilles, og hvordan de adskiller sig,« fastslår Hannes Gonschior, førsteforfatter til undersøgelsen, som udførte sin ph.d. afhandling om emnet ved FMP. "Denne organisation i nanoskala var tidligere ukendt."
Først blev undersøgelserne udført på cellulært niveau og derefter i tarm- og nyrevæv fra mus. Slående billeder gengav de fluorescerende mærkede proteiner i forskellige farver, der viser, hvor hvilke proteiner er placeret, og hvordan de kædes sammen til en farverig lynlås.
Tre resultater fra undersøgelsen, nu offentliggjort i Nature Communications , er af særlig betydning:
- For det første:Claudins forsegler intercellulære rum for ioner og små molekyler - meget ligesom en lynlås. Disse tætninger er selektivt iongennemtrængelige, afhængigt af vævet og sammensætningen af den tætte forbindelse.
- For det andet:En ud af to claudiner er ude af stand til at polymerisere til strenge. De er afhængige af, at andre teammedlemmer kan danne og "funktionalisere" et tæt knudepunkt.
- For det tredje:Claudins interagerer med hinanden i fem organisationsprincipper. Det betyder, at der er fem forskellige måder, hvorpå de kan blandes eller adskilles.
Oprettelse af model for lægemiddelopdagelse
Det faktum, at FMP-forskere for første gang har været i stand til at bestemme tight junctions i nanoskala, er en stor succes for grundforskningen. Men medicin kan også nyde godt af gennembruddet. Dette skyldes, at mutationer i claudins spiller en rolle i en række arvelige sygdomme, hvor den mest oplagte er HELIX-syndromet - en sjælden tilstand, der forårsager nedsat svedproduktion.
En mutation i claudin 10b er synderen, der forårsager hypohidrose og tåre- og spytkirteldefekter samt nedsat calcium- og magnesiumregulering i nyrerne. Holdet af forskere havde også eksperimenteret med denne sygdomsmutant.
"Vores forskning er stadig langt fra at have klinisk relevans," sagde biofysiker Martin Lehmann, der vurderede deres resultater. "Men nu forstår vi i det mindste, hvordan disse meshworks er opbygget. Dette er det første skridt, som vil give os mulighed for at søge efter små molekyler, der åbner eller lukker disse barrierer."
Cellebiolog Hannes Gonschior tilføjede, at de "har fundet en forenklet model for lægemiddelopdagelse og mere generelt udført forskning i paracellulær passage af ioner. Det er meget sandsynligt, at vores resultater vil gøre os i stand til at forstå tidligere uforklarlige kliniske fænotyper og symptomer - med en defekt i en af disse særlige paracellulære barrierer." + Udforsk yderligere
Lukning af hullet:En to-lags mekanisme til epitelbarriere
Sidste artikelGenbrug af 1 kg tøj sparer 25 kg CO2, viser undersøgelse
Næste artikelForsker opdager ny oxidationstilstand for rhodium
 Varme artikler
Varme artikler
-
 Nanostrukturerede siloxan-baserede materialer til nye plastik og mikroelektronikBrigitte Lamers forsvarede sin ph.d.-afhandling om samspillet mellem faseadskillelse og supramolekylære interaktioner. Kredit:Eindhoven University of Technology Selvorganiseringen af molekylære
Nanostrukturerede siloxan-baserede materialer til nye plastik og mikroelektronikBrigitte Lamers forsvarede sin ph.d.-afhandling om samspillet mellem faseadskillelse og supramolekylære interaktioner. Kredit:Eindhoven University of Technology Selvorganiseringen af molekylære -
 Ukonventionel løsningsproces til 2-D heterostrukturSkematisk model af MAPbBr3 || MoS2 epitaksialt forhold. Kredit:Science China Press Opløsningsforarbejdede overgangsmetalchalcogenid (TMD) nanosheets udviser begrænset lysabsorption og lav kvanteef
Ukonventionel løsningsproces til 2-D heterostrukturSkematisk model af MAPbBr3 || MoS2 epitaksialt forhold. Kredit:Science China Press Opløsningsforarbejdede overgangsmetalchalcogenid (TMD) nanosheets udviser begrænset lysabsorption og lav kvanteef -
 Lab afslører hjerte-på-en-chipGennem hjerte-på-en-chip-teknologi - modellering af et menneskeligt hjerte på en konstrueret chip og måling af virkningerne af forbindelseseksponering ved hjælp af mikroelektroder - håber Lawrence Liv
Lab afslører hjerte-på-en-chipGennem hjerte-på-en-chip-teknologi - modellering af et menneskeligt hjerte på en konstrueret chip og måling af virkningerne af forbindelseseksponering ved hjælp af mikroelektroder - håber Lawrence Liv -
 Isopropanol Alkohol Vs. IsopropylalkoholIsopropylalkohol - også kendt som isopropanol - er almindeligt kendt som gnidning af alkohol. Typisk blandes isopropylalkohol solgt til forbrugerbrug med vand og sælges som en antiseptisk eller ren
Isopropanol Alkohol Vs. IsopropylalkoholIsopropylalkohol - også kendt som isopropanol - er almindeligt kendt som gnidning af alkohol. Typisk blandes isopropylalkohol solgt til forbrugerbrug med vand og sælges som en antiseptisk eller ren
- Sidste års bedste:De bedste Phys.org-artikler i 2019
- Hvad er social struktur, og hvorfor hjælper det nogle, men skader andre?
- Er det at klippe snoren en del af dit nytårsforsæt? Her er hvad du behøver at vide
- Tidlig forårsregn øger metan fra optøende permafrost med 30 procent
- Typer af støbeprocesser
- Computerprogram registrerer forskelle mellem menneskelige celler


