Forskere identificerer O-GlcNAcylering som årsag til bugspytkirteltumorvækst ved at regulere MDH1
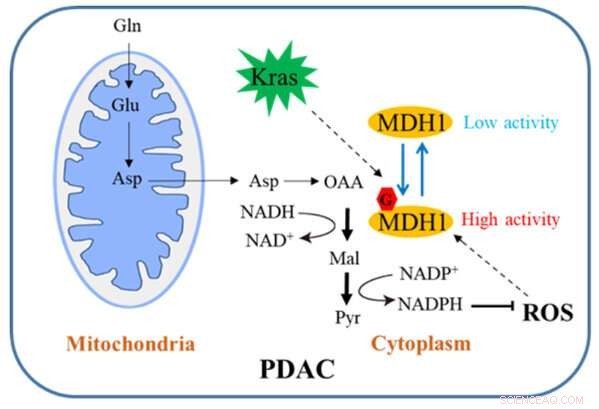
Skematisk diagram af, hvordan MDH1-glykosylering regulerer PDAC-vækst. Kredit:Zhejiang University
Bugspytkirtelkræft er en yderst ondartet tumor i fordøjelsessystemet, og dens femårige overlevelsesrate er lidt mere end 10%. Metaboliske ændringer er et af kendetegnene for tumorceller. Onkogene Kras-aktiverede pancreas duktal adenokarcinom (PDAC) celler er stærkt afhængige af en ukonventionel glutamin (Gln) katabolisk vej for at opretholde cellevækst.
I den konventionelle vej omdannes Gln først til aspartat (Asp), som transporteres fra mitokondrier ind i cytosolen, hvor det sekventielt omdannes af aspartat transaminase 1 (GOT1), MDH1 og æblesyreenzym 1 (ME1) til pyruvat og NADPH. Denne vej er kritisk for PDAC-celler for at opretholde redox-homeostase og er nødvendig for cellulær proliferation og tumorvækst in vivo. Derfor kan en indsigtsfuld forståelse af denne reguleringsmekanisme meget vel åbne en ny vej til den kliniske behandling af PDAC.
Forskerholdet ledet af prof. Zhou Ruhong og prof. Yi Wen fra Zhejiang University College of Life Sciences offentliggjorde en artikel i tidsskriftet Nature Chemical Biology den 25. juli. Denne artikel afslører, at O-GlcNAcylering bidrager til vækst i bugspytkirtelkræft ved at regulere den metaboliske aktivitet af malatdehydrogenase 1 (MDH1). Dette fund har enorme implikationer for udviklingen af lægemidler til bugspytkirteltumor.
Holdet har udført relevant forskning. Deres undersøgelse viser, at Kras-mutation inducerer cellulær O-bundet β-N-acetylglucosamin (O-GlcNAc), en udbredt form for proteinglykosylering. Malatdehydrogenase 1 (MDH1), et nøgleenzym i den kataboliske glutamin-vej, er positivt reguleret af O-GlcNAcylering på serin 189 (S189).
Molekylær dynamik simuleringer tyder på, at S189 glycosylering på monomer MDH1 øger stabiliteten af den substratbindende lomme og styrker substratinteraktionerne ved at tjene som en molekylær lim. Udtømning af O-GlcNAcylering reducerer MDH1-aktivitet, forringer glutaminmetabolisme, sensibiliserer PDAC-celler over for oxidativt stress, nedsætter celleproliferation og hæmmer tumorvækst hos nøgne mus. Ydermere er O-GlcNAcyleringsniveauer af MDH1 forhøjede i kliniske PDAC-prøver.
Identifikationen af specifikke veje og proteiner med unik afhængighed af O-GlcNAc er uundværlig for at udvikle målrettede terapier. Undersøgelsen af prof. Zhou og prof. Yi et al. afslører, at MDH1-glykosylering er klar til at regulere den unikke Gln-metaboliske vej i PDAC, hvilket fremhæver potentialet for at intervenere i MDH1-glykosylering som en terapeutisk strategi mod PDAC. + Udforsk yderligere
Forskere opdager molekyle, der dræber bugspytkirtelkræftceller
 Varme artikler
Varme artikler
-
 Ny teori styrker det, vi ved om, hvordan ladede makromolekyler samler sig selvKredit:Shibananda Das I en opdagelse med vidtrækkende implikationer annoncerede forskere ved University of Massachusetts Amherst for nylig i Proceedings of the National Academy of Sciences at ensar
Ny teori styrker det, vi ved om, hvordan ladede makromolekyler samler sig selvKredit:Shibananda Das I en opdagelse med vidtrækkende implikationer annoncerede forskere ved University of Massachusetts Amherst for nylig i Proceedings of the National Academy of Sciences at ensar -
 Biomimetisk strategi fører til stærke, genanvendeligt gummiKredit:Wiley Inspireret af naturen, Kinesiske videnskabsmænd har fremstillet en syntetisk analog til vulkaniseret naturgummi. Deres materiale er lige så hårdt og holdbart som originalen. I journal
Biomimetisk strategi fører til stærke, genanvendeligt gummiKredit:Wiley Inspireret af naturen, Kinesiske videnskabsmænd har fremstillet en syntetisk analog til vulkaniseret naturgummi. Deres materiale er lige så hårdt og holdbart som originalen. I journal -
 Forskere udvikler en elektrokemisk platform til cellefri syntetisk biologiDet nye biohybridsystem bruger ikke-optiske reporterenzymer indeholdt i 16 mikroliter væske, som parrer specifikt med mikromønstrede elektroder, der er hostet på en lille chip, der ikke er mere end en
Forskere udvikler en elektrokemisk platform til cellefri syntetisk biologiDet nye biohybridsystem bruger ikke-optiske reporterenzymer indeholdt i 16 mikroliter væske, som parrer specifikt med mikromønstrede elektroder, der er hostet på en lille chip, der ikke er mere end en -
 Forskere peger på, hvordan sorberende materialer fanger og frigiver kulstofKredit:Unsplash/CC0 Public Domain En nøglekomponent i DAC-systemer (ambient direct air capture), der fjerner kuldioxid fra luften, er det sorberende materiale, der bruges til først at opfange kuls
Forskere peger på, hvordan sorberende materialer fanger og frigiver kulstofKredit:Unsplash/CC0 Public Domain En nøglekomponent i DAC-systemer (ambient direct air capture), der fjerner kuldioxid fra luften, er det sorberende materiale, der bruges til først at opfange kuls
- Forskere afslører transportmekanismen for atmosfærisk mikroplast
- ORNL hold med Los Alamos, EPB for at demonstrere næste generations netsikkerhedsteknologi
- 5 ting at vide om den nye FN-rapport om klimaændringer
- Matematisk modellering af HIV-lægemiddelfarmakodynamik
- La Nina klimacyklus kan genopstå i 2021:FN
- Hvordan får man renere luft? Tyskland overvejer fri massetransit


