Udnyttelse af strukturen af bakterielle værtscellereceptorer til at påvise cancer
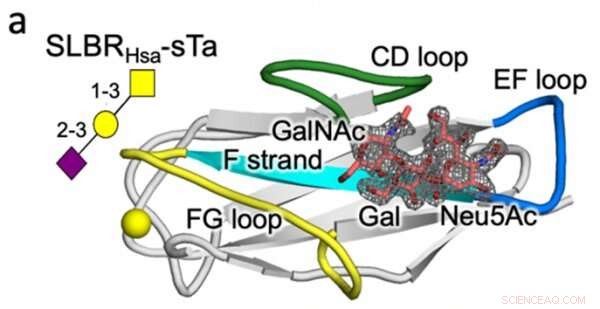
Krystalstruktur af en streptococcus SLBR (Hsa) binding med høj affinitet til værtscellens glycanreceptor (sTa). Variation i sekvens og struktur af de mærkede SLBR-proteinsløjfer (CD, EF og FG) forudsiges at kontrollere receptorbindingsselektivitet. Kredit:Vanderbilt University
Bakterier i vores kroppe binder sig til forskellige værtscelleoverfladereceptorer, som bestemmer, hvor bakterierne bor, og hvordan de opfører sig. Disse receptorer, der består af kæder af sukkermolekyler kaldet glycaner, er mere end man kan se. Celler, der eksisterer i progressive sygdomstilstande som cancer, kan have et øget antal glycanreceptorer på deres overflader.
Laboratoriet af Tina Iverson, Louise B. McGavock Chair og professor i farmakologi, afslørede den strukturelle mekanisme, hvorved streptokokbakterier binder sig til værtscelleglykaner, hvilket åbner døren til nye måder at bruge bakterielle molekyler til potentielt at opdage cancerceller.
Tidligere forskning har vist, at bakterier som streptokokker bruger klæbende molekyler kaldet SLBR'er til at binde sig til glycanreceptorer på overfladen af værtsceller. Iverson-laboratoriet antog, at disse bakterier kan tilpasse strukturen af deres SLBR'er til at binde sig til en bred vifte af værtsglycan-receptorer for at hjælpe dem med at bebo nye nicher i kroppen.
Med hensyn til proteinteknik bestemte Iverson-laboratoriet, hvilke SLBR-strukturelementer, der styrer valget af værtscellereceptorbinding. Ved kunstigt at modificere DNA'et, der koder for SLBR'er og oprense de resulterende proteiner fra bakterier, opdagede de, at tre sløjfer i SLBR'en - kaldet CD, EF og FG - kontrollerer, hvilke glykaner bakterierne vil binde sig til.
Bakteriel binding til værtscellereceptorer er det første trin i infektion. Forståelse af mekanismen bag denne proces kan også hjælpe forskere med at identificere celler beriget med overfladeglykaner, der findes i sygdomstilstande.
Som en del af denne undersøgelse fandt Iverson-laboratoriet, at kommensale bakterier i munden binder sig til et sukkerbelagt eller glykosyleret protein i munden, som også er overrepræsenteret i meget aggressive cancerceller i de fleste karcinomer. Ved at udvikle teknikker, der ændrer SLBR-glykanselektiviteten, er Iverson fast besluttet på at tackle et nyt langsigtet mål:at udvikle reagenser, der kan identificere meget aggressive kræftformer. De glycaner, som celler udtrykker, kan tjene som biomarkører til at hjælpe læger med at målrette sygdomme til terapeutisk intervention.
"Vi arbejder på at udvide et bibliotek af glycanbindende midler, vi udviklede i denne undersøgelse, for at give os mulighed for at opdage et større udvalg af glycaner," sagde Iverson, også professor i biokemi. "Til sidst vil vi gerne udvikle det til diagnostiske kits."
Undersøgelsen "Origins of glycan selectivity in streptococal Siglec-like adhesins suggest mechanisms of receptor adaptation" blev offentliggjort i Nature Communications i maj 2022. + Udforsk yderligere
Sukkerkæder på celleoverflader leder kræftceller til at dø
 Varme artikler
Varme artikler
-
 Forskere offentliggør en komplet oversigt over sulfonimiddendrimererKredit:Skolkovo Institut for Videnskab og Teknologi Et forskerhold fra Skoltech Center for Design, Manufacturing and Materials (CDMM) har udarbejdet en omfattende oversigt over forskning i en fami
Forskere offentliggør en komplet oversigt over sulfonimiddendrimererKredit:Skolkovo Institut for Videnskab og Teknologi Et forskerhold fra Skoltech Center for Design, Manufacturing and Materials (CDMM) har udarbejdet en omfattende oversigt over forskning i en fami -
 At få fermenterede mejeriprodukter til at smage bedreEmmental ost. Kredit:Wikipedia Forskere ved det tekniske universitet i München (TUM), Leibniz-instituttet for fødevaresystembiologi, og University of Hohenheim har udviklet en ny metodisk tilgang
At få fermenterede mejeriprodukter til at smage bedreEmmental ost. Kredit:Wikipedia Forskere ved det tekniske universitet i München (TUM), Leibniz-instituttet for fødevaresystembiologi, og University of Hohenheim har udviklet en ny metodisk tilgang -
 Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtidHarpiksen, der udskilles af et beskadiget nåletræ for at beskytte skadestedet, har sin egen karakteristiske chirale signatur inden for anlæggets samlede emissioner. Kredit:Lykourgos Bougas Den chir
Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtidHarpiksen, der udskilles af et beskadiget nåletræ for at beskytte skadestedet, har sin egen karakteristiske chirale signatur inden for anlæggets samlede emissioner. Kredit:Lykourgos Bougas Den chir -
 Cu-Fe-katalysator letter omgivelsestrykkonvertering af CO2 til langkædede olefinerStrukturelle karakteriseringer af aktiveret CuFeO2 . et HAADF-billede af aktiveret CuFeO2 . b XRD-profiler for aktiveret CuFeO2 . c Mössbauer-spektre af aktiveret CuFeO2 2. d Cu LMM Auger, e Fe2p XPS
Cu-Fe-katalysator letter omgivelsestrykkonvertering af CO2 til langkædede olefinerStrukturelle karakteriseringer af aktiveret CuFeO2 . et HAADF-billede af aktiveret CuFeO2 . b XRD-profiler for aktiveret CuFeO2 . c Mössbauer-spektre af aktiveret CuFeO2 2. d Cu LMM Auger, e Fe2p XPS
- Brandbrande og beskyttelse af hjem mod naturbrande:Forståelse af flammende vindblæst affald
- Fungerende Apple-computer bygget i 1970'erne på auktion
- NASA finder en lille tropisk storm Kiko
- Forskel Mellem Mand & Kvinde Tilapia
- Juno-rumfartøjet opdaterer Jupiter-mysteriet fra kvart århundrede
- 60 år siden 1. amerikaner i rummet:Turister står i kø


