Visualisering af bindingsprocesser af celle-celle-adhæsionsmolekyler i opløsning
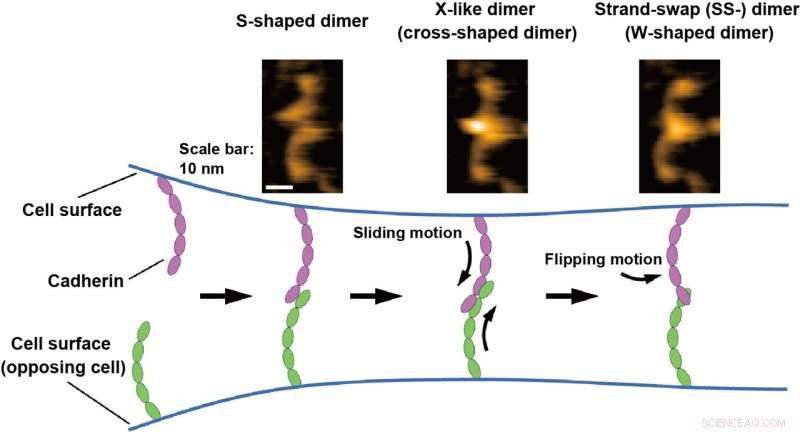
HS-AFM billeder af cadherin dimererne er vist øverst. Bindingsmekanismen for cadheriner er illustreret i bunden baseret på HS-AFM-observationer. Kredit:Shigetaka Nishiguchi fra videnskabsmænd ved Exploratory Research Center on Life and Living Systems (ExCELLS)
Celle-, vævs- og organstruktur opretholdes af celle-celle-adhæsionsmolekyler, der forbinder modstående celler. Cadheriner er en klasse af essentielle cellecelleadhæsionsmolekyler til vævsdannelse og integritet, og defekter i cadherinfunktionen forårsager forskellige sygdomme (f.eks. cancerinvasion). Cadherin rager ud fra celleoverfladen og binder en anden cadherin på en modstående celle for at mediere celle-celle-adhæsion. Cadherinbindingsprocessen omfatter hovedsageligt to dimeriseringstrin:X-dimer dannelse og streng-swap (SS-) dimer dannelse af de ekstracellulære domæner (ektodomæner) af cadherin. Imidlertid er andre interaktioner end dem, der involverer dannelsen af X- og SS-dimererne, også blevet foreslået, og den præcise bindingsmekanisme af cadherin forbliver kontroversiel.
Shigetaka Nishiguchi fra ExCELLS, Takayuki Uchihashi fra ExCELLS og Nagoya University og Tadaomi Furuta fra Tokyo Tech anvendte højhastigheds atomkraftmikroskopi (HS-AFM) for at udforske bindingsmekanismen for cadheriner. HS-AFM kan muliggøre visualisering af enkelt-molekyle strukturer og dynamik i opløsning på nanometer skala med sub-sekund tidsopløsning ved direkte at røre og scanne overfladen af proteiner gennem en skarp spids sonde. HS-AFM afslørede, at cadheriner eksisterede som multiple dimere strukturer, som baseret på deres morfologi kan klassificeres som W-, kryds- og S-formede dimerer.
Desuden udførte forskerne mutations- og strukturelle modelleringsanalyser og fandt ud af, at W- og krydsformede dimerer svarede til kendte SS-dimerer og X-lignende dimerer, og at den S-formede dimer er en ny konformation. Bindingsprocesserne af cadheriner direkte visualiseret af HS-AFM afslørede også, at dimeriseringsprocessen er afsluttet inden for et sekund gennem konvertering til de førnævnte tre typer dimere strukturer. Baseret på disse HS-AFM-observationer antog forskerne, at bindingsmekanismen udvikler sig gennem glidebevægelsen af den S-formede dimer efterfulgt af vendebevægelsen af X-dimeren for at danne SS-dimeren, som menes at være den sidste stabil cadherin dimer.
Til dato er bindingsmekanismen for cadheriner hovedsageligt blevet undersøgt ved hjælp af strukturelle analyser og celle- og opløsningsmålinger, som kun kan analysere de bindingstilstande, der afspejles af det store antal cadheriner. Den nyligt anvendte HS-AFM-teknik afslørede bindingsprocesserne for individuelle cadheriner ved enkeltmolekyle opløsning, hvilket ikke er blevet opnået før. HS-AFM-observation vil bane vejen for en dybere forståelse af bindingsmekanismen af cadheriner, som er vigtig for vævs- og organ-niveau organisation og celle-celle adhæsion-relaterede sygdomme.
Forskningen blev offentliggjort i Proceedings of the National Academy of Sciences . + Udforsk yderligere
Resultater afslører en ny aktiveringsmekanisme for ALK
 Varme artikler
Varme artikler
-
 Frostvæske fisk inspirerer til nye kryobeskyttelsesmidler til menneskelige celler og vævKredit:Horizon:The EU Research &Innovation Magazine Ideen om kryogenisk at fryse en person for at bevare deres krop indtil mange år ud i fremtiden har længe været en fast bestanddel af science fic
Frostvæske fisk inspirerer til nye kryobeskyttelsesmidler til menneskelige celler og vævKredit:Horizon:The EU Research &Innovation Magazine Ideen om kryogenisk at fryse en person for at bevare deres krop indtil mange år ud i fremtiden har længe været en fast bestanddel af science fic -
 Optimering af lithium-svovl batterielektrolytter for lang levetidGenopladelige lithium-svovl batterier, hvor elektroderne er lavet af lithium (Li) metal og svovl (S) adskilt af en flydende elektrolyt, kunne erstatte lithium-ion-batterier, hvis vi kunne forstå, hvor
Optimering af lithium-svovl batterielektrolytter for lang levetidGenopladelige lithium-svovl batterier, hvor elektroderne er lavet af lithium (Li) metal og svovl (S) adskilt af en flydende elektrolyt, kunne erstatte lithium-ion-batterier, hvis vi kunne forstå, hvor -
 Et afgørende enzym blev endelig afsløretKredit:CEA Efter 40 års forskning, forskere ved CEA, CNRS, Universitetet i Grenoble-Alperne, Universitetet i Montpellier og Inserm har endelig identificeret det enzym, der er ansvarligt for tubuli
Et afgørende enzym blev endelig afsløretKredit:CEA Efter 40 års forskning, forskere ved CEA, CNRS, Universitetet i Grenoble-Alperne, Universitetet i Montpellier og Inserm har endelig identificeret det enzym, der er ansvarligt for tubuli -
 Avanceret mikroskopi afslører usædvanlig DNA-strukturAdam Backer, en optisk videnskabsmand ved Sandia National Laboratories, hjulpet med at udvikle en avanceret mikroskopiteknik, der afslørede stærkt hældende basepar i en strakt form af DNA. Kredit:Rand
Avanceret mikroskopi afslører usædvanlig DNA-strukturAdam Backer, en optisk videnskabsmand ved Sandia National Laboratories, hjulpet med at udvikle en avanceret mikroskopiteknik, der afslørede stærkt hældende basepar i en strakt form af DNA. Kredit:Rand
- Gulf Coast seler, igen, for orkan, da Zeta tager sigte
- Project Silica proof of concept stores Warner Bros. Superman-film på kvartsglas
- Los Angeles:Hollywood, palmer og urbane oliefelter
- For at forestille sig 5G-fremtiden, gense vores seneste trådløse fortid
- Mindre flokkende adfærd blandt mikroorganismer reducerer risikoen for at blive spist
- Lille membran gør Sydney Harbour drikkelig


