Soldrevet kemi bruger kuldioxid og vand til at fremstille råmaterialer til brændstoffer, kemikalier
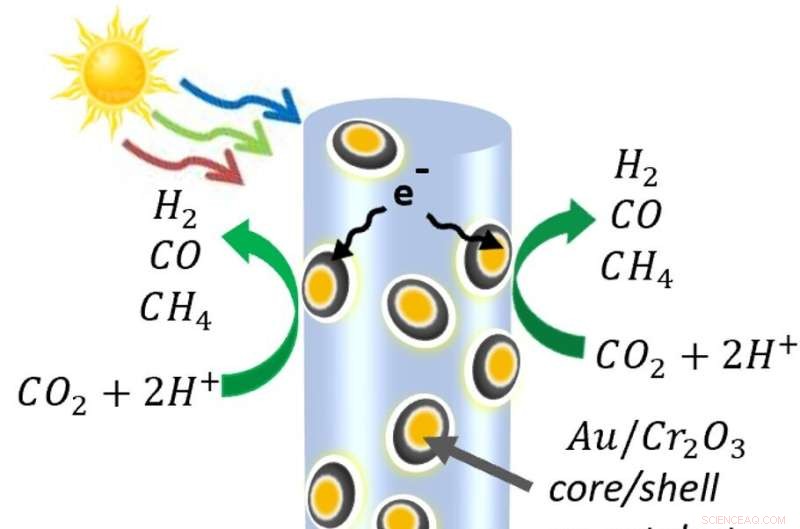
Et diagram over halvledernannotrådene lavet af indium, gallium og nitrogen - dekoreret med guld- og kromoxidnanopartikler. Når lyset rammer nanotråden, frigør det elektroner og de positivt ladede "huller", som elektroner efterlader. På selve nanotråden oxiderer hullerne vand til protoner (brint) og ilt. I mellemtiden trækkes nogle elektroner ind i metalnanopartiklerne, hvor de bryder kuldioxid fra hinanden. Molekylerne rekombinerer til carbonmonoxid-, brint- og metanmolekylerne, der udgør syngas. Kredit:Roksana Rashid, McGill University.
Solar-drevet syntesegas kan genbruge kuldioxid til brændstoffer og nyttige kemikalier, har et internationalt hold af forskere vist.
"Hvis vi kan generere syngas fra kuldioxid udelukkende ved at bruge solenergi, kan vi bruge dette som en forløber for methanol og andre kemikalier og brændstoffer. Dette vil reducere den samlede CO2 markant. emissioner," sagde Zetian Mi, professor i elektro- og computerteknik ved University of Michigan, som ledede undersøgelsen offentliggjort i Proceedings of the National Academy of Science .
Syngas, der hovedsageligt består af brint og kulilte med lidt metan, er almindeligvis afledt af fossile brændstoffer ved hjælp af elektricitet. Derudover tilsættes ofte giftige kemikalier for at gøre processen mere effektiv.
"Vores nye proces er faktisk ret simpel, men det er spændende, fordi det ikke er giftigt, det er bæredygtigt og det er meget omkostningseffektivt," sagde Roksana Rashid, førsteforfatter til undersøgelsen, som udførte eksperimenterne som doktorand i elektro- og computerteknik på McGill University i Canada.
For at skabe en proces, der kun bruger solenergi, overvandt Mi's gruppe vanskeligheden med at spalte kuldioxid-molekyler, som er blandt de mest stabile i universet. Til dette peppede de en skov af halvleder-nanotråde med nanopartikler. Disse nanopartikler, lavet af guld belagt med chromoxid, tiltrak kuldioxidmolekylerne og bøjede dem, hvilket svækkede bindingerne mellem kulstof og ilt.
Galliumnitrid nanotrådene brugte lysenergien til at frigøre elektroner og de positivt ladede rum, de efterlader, kendt som huller. Hullerne splitter vandmolekyler og adskiller protonerne (brint) fra ilten. Derefter, ved metalkatalysatorerne, spalter elektronerne kuldioxiden, producerer kulilte og trækker nogle gange det frie brint ind for at lave metan. Processer er under udvikling for at adskille ilten fra de andre gasser.
"Vores teknologi kaster lys over, hvordan man bygger distribueret syngasproduktion fra luft, vand og sollys," siger Baowen Zhou, der er co-korresponderende forfatter til undersøgelsen sammen med Mi og en tidligere postdoc-forsker i Mi's laboratorium ved McGill University og U-M.
Ved at ændre forholdet mellem guld og chromoxid i nanopartiklerne var Mi's team i stand til at kontrollere de relative mængder af brint og carbonmonoxid produceret i reaktionen. Dette er vigtigt, fordi forholdet mellem brint og kulilte påvirker, hvor let det er at fremstille en type brændstof eller kemikalie.
"Hvad der er overraskende er synergien mellem guld og chromoxid til at lave CO2 reduktion til syngas effektiv og justerbar. Det var ikke muligt med en enkelt metalkatalysator," sagde Mi. "Dette åbner op for mange spændende muligheder, som ikke tidligere var overvejet."
Mi's tunbare syngas-opsætning bruger standard industrielle fremstillingsprocesser og er skalerbar. Mens Rashid brugte destilleret vand i dette eksperiment, forventes havvand og andre elektrolytopløsninger også at virke, og Mi har brugt dem i relaterede vandspaltningsundersøgelser.
"Den halvleder, vi bruger som lysabsorber, er baseret på silicium og galliumnitrid, som er de mest almindeligt producerede halvledere, og vi bruger meget lidt materiale til galliumnitrid. Hver nanotråd er omkring en mikrometer i tykkelse," sagde Mi.
Mi's næste mål er at øge effektiviteten af enheden, som i øjeblikket ligger på 0,89%. Når 10 % af lysenergien omdannes til kemisk energi, håber han, at teknologien kunne se, at teknologien bliver taget i brug til vedvarende energi, i lighed med solceller. + Udforsk yderligere
'Grøn metan' fra kunstig fotosyntese kunne genbruge CO2
 Varme artikler
Varme artikler
-
 Hvilken reaktionstype producerer en præcipitat?Opløsninger kan gennemgå en kemisk reaktion for at producere et uopløseligt fast stof. Det faste stof kaldes bundfaldet, der vises som sediment i bunden af opløsningen eller som en suspension i oplø
Hvilken reaktionstype producerer en præcipitat?Opløsninger kan gennemgå en kemisk reaktion for at producere et uopløseligt fast stof. Det faste stof kaldes bundfaldet, der vises som sediment i bunden af opløsningen eller som en suspension i oplø -
 Undersøge vand af en elektrificerende årsagKAUST-forskere observerede, at vedhængende dråber dannet fra hydrofobe kapillærer til ensartede elektriske felter. Kredit:KAUST; Anastasia Serin Et eksperiment, elegant i sin enkelhed, hjælper med
Undersøge vand af en elektrificerende årsagKAUST-forskere observerede, at vedhængende dråber dannet fra hydrofobe kapillærer til ensartede elektriske felter. Kredit:KAUST; Anastasia Serin Et eksperiment, elegant i sin enkelhed, hjælper med -
 Hvorfor popper balloner, når de sidder i en varm bil?Det er fint at hente heliumballoner fra en butik og tage dem med hjem i din bil, men det er bestemt ikke en god ide at lade dem stå i en varm bil til lang tid. Dette skyldes, at heliummolekyler bliver
Hvorfor popper balloner, når de sidder i en varm bil?Det er fint at hente heliumballoner fra en butik og tage dem med hjem i din bil, men det er bestemt ikke en god ide at lade dem stå i en varm bil til lang tid. Dette skyldes, at heliummolekyler bliver -
 Smarte polymerer omdanner elektrisk energi til mekanisk arbejdeKredit:Swiss Federal Laboratories for Materials Science and Technology CT-systemer, et spin-off af Empa, og Daetwyler, den schweiziske specialist i tætningsløsninger, partner til at markedsføre og
Smarte polymerer omdanner elektrisk energi til mekanisk arbejdeKredit:Swiss Federal Laboratories for Materials Science and Technology CT-systemer, et spin-off af Empa, og Daetwyler, den schweiziske specialist i tætningsløsninger, partner til at markedsføre og
- Dyr fra økosystemet
- Nyt scenarie for kollisionsdynamikken mellem Indien og Asien
- Undersøgelse af klimaeffekter af regional nuklear udveksling
- Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbeton
- Porsche-aktien stiger i en af Europas største markedsdebuter
- Fossilt brændstofselskabers fremskrivninger opfylder ikke klimamålene fra Parisaftalen


