Afkodning af en nøgledel af cellen atom for atom

Kredit:Valerie Altounian
Uanset hvad du laver, om det er at køre bil, gå en løbetur eller endda på din dovneste måde, spise chips og se tv på sofaen, er der en hel suite af molekylært maskineri inde i hver af dine celler, der arbejder hårdt. Det maskineri, der er alt for lille til at se med det blotte øje eller endda med mange mikroskoper, skaber energi til cellen, fremstiller dens proteiner, laver kopier af dens DNA og meget mere.
Blandt disse maskiner, og en af de mest komplekse, er noget kendt som det nukleare porekompleks (NPC). NPC'et, som er lavet af mere end 1.000 individuelle proteiner, er en utroligt diskriminerende gatekeeper for cellens kerne, den membranbundne region inde i en celle, der rummer cellens genetiske materiale. Alt, der går ind eller ud af kernen, skal passere gennem NPC på sin vej.
NPC's rolle som gatekeeper af kernen betyder, at den er afgørende for cellens operationer. Inden i kernen kopieres DNA, cellens permanente genetiske kode, til RNA. Det RNA føres derefter ud af kernen, så det kan bruges til at fremstille de proteiner, cellen har brug for. NPC'en sikrer, at kernen får de materialer, den har brug for til at syntetisere RNA, samtidig med at den beskytter DNA'et mod det barske miljø uden for kernen og gør det muligt for RNA'et at forlade kernen, efter at det er blevet fremstillet.
"Det er lidt ligesom en flyhangar, hvor man kan reparere 747'ere, og døren åbner for at lade 747'eren komme ind, men der står en person, som kan forhindre en enkelt marmor i at komme ud, mens dørene er åbne," siger Caltechs André Hoelz, professor i kemi og biokemi og fakultetsstipendiat ved Howard Hughes Medical Institute. I mere end to årtier har Hoelz studeret og dechifreret strukturen af NPC i forhold til dens funktion. I årenes løb har han støt taget fat i dets hemmeligheder og optrevlet dem stykke for stykke for stykke.
Implikationerne af denne forskning er potentielt enorme. Ikke alene er NPC central for cellens operationer, den er også involveret i mange sygdomme. Mutationer i NPC er ansvarlige for nogle uhelbredelige kræftformer, for neurodegenerative og autoimmune sygdomme, såsom amyotrofisk lateral sklerose (ALS) og akut nekrotiserende encefalopati, og for hjertesygdomme, herunder atrieflimren og tidlig pludselig hjertedød. Derudover målretter og lukker mange vira, inklusive den, der er ansvarlig for COVID-19, NPC'en i løbet af deres livscyklus.
Nu, i et par artikler offentliggjort i tidsskriftet Science , beskriver Hoelz og hans forskerhold to vigtige gennembrud:Bestemmelsen af strukturen af den ydre flade af NPC og belysningen af mekanismen, hvorved specielle proteiner fungerer som en molekylær lim til at holde NPC'en sammen.
Et meget lille 3D-puslespil
I deres papir med titlen "Architecture of the cytoplasmic face of the nuclear pore" beskriver Hoelz og hans forskerhold, hvordan de kortlagde strukturen af den side af NPC, der vender udad fra kernen og ind i cellens cytoplasma. For at gøre dette skulle de løse det, der svarer til et meget lille 3D-puslespil, ved at bruge billeddannelsesteknikker som elektronmikroskopi og røntgenkrystallografi på hver puslespilsbrik.
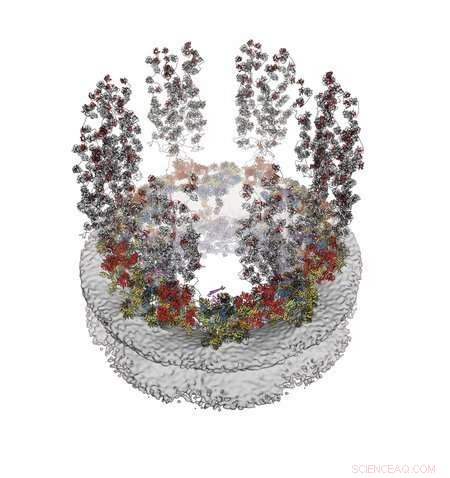
En molekylær model af den ydre (cytoplasmatiske) overflade af det nukleare porekompleks. Genoptrykt med tilladelse fra C.J. Bley et al., Science 376, eabm9129 (2022). Kredit:Hoelz laboratory/Caltech
Stefan Petrovic, en kandidatstuderende i biokemi og molekylær biofysik og en af de første forfattere af artiklerne, siger, at processen begyndte med Escherichia coli-bakterier (en bakteriestamme, der almindeligvis bruges i laboratorier), der blev gensplejset til at producere de proteiner, der udgør den menneskelige NPC.
"Hvis du går ind i laboratoriet, kan du se denne gigantiske væg af kolber, hvor kulturer vokser," siger Petrovic. "Vi udtrykker hvert enkelt protein i E. coli-celler, bryder disse celler op og oprenser kemisk hver proteinkomponent."
Da den oprensning – som kan kræve så meget som 1.500 liter bakteriekultur for at få nok materiale til et enkelt eksperiment – var fuldført, begyndte forskerholdet møjsommeligt at teste, hvordan stykkerne af NPC passer sammen.
George Mobbs, en senior postdoc-forsker i kemi og en anden medførsteforfatter af papiret, siger, at samlingen skete på en "trinvis" måde; i stedet for at hælde alle proteinerne sammen i et reagensglas på samme tid, testede forskerne par af proteiner for at se, hvilke der ville passe sammen, som to puslespilsbrikker. Hvis der blev fundet et par, der passede sammen, ville forskerne derefter teste de to nu kombinerede proteiner mod et tredje protein, indtil de fandt et, der passede med det par, og så blev den resulterende tredelte struktur testet mod andre proteiner, og så på. At arbejde sig igennem proteinerne på denne måde gav til sidst det endelige resultat af deres papir:en 16-protein kile, der gentages otte gange, ligesom skiver af en pizza, for at danne ansigtet af NPC.
"Vi rapporterede den første komplette struktur af hele det cytoplasmatiske ansigt af den menneskelige NPC, sammen med streng validering, i stedet for at rapportere en række trinvise fremskridt af fragmenter eller dele baseret på delvis, ufuldstændig eller lav opløsning observation," siger Si Nie , postdoc-forsker i kemi og også en medførsteforfatter af papiret. "Vi besluttede at vente tålmodigt, indtil vi havde fået alle nødvendige data, og rapporterede en enorm mængde ny information."
Deres arbejde supplerede forskning udført af Martin Beck fra Max Planck Institute of Biophysics i Frankfurt, Tyskland, hvis hold brugte kryo-elektrontomografi til at generere et kort, der gav konturerne af et puslespil, som forskerne skulle placere brikkerne i. For at fremskynde færdiggørelsen af puslespillet om den menneskelige NPC-struktur udvekslede Hoelz og Beck data for mere end to år siden og byggede derefter uafhængigt strukturer af hele NPC. "Det væsentligt forbedrede Beck-kort viste meget tydeligere, hvor hvert stykke af NPC'en - som vi bestemte atomstrukturerne for - skulle placeres, beslægtet med en træramme, der definerer kanten af et puslespil," siger Hoelz.
De eksperimentelt bestemte strukturer af NPC-stykkerne fra Hoelz-gruppen tjente til at validere Beck-gruppens modellering. "Vi placerede strukturerne på kortet uafhængigt ved hjælp af forskellige tilgange, men de endelige resultater stemte helt overens. Det var meget tilfredsstillende at se det," siger Petrovic.
"Vi byggede en ramme, hvorpå en masse eksperimenter nu kan udføres," siger Christopher Bley, en senior postdoc-forsker i kemi og også med-førsteforfatter. "Vi har denne sammensatte struktur nu, og den muliggør og informerer fremtidige eksperimenter om NPC-funktion, eller endda sygdomme. Der er mange mutationer i NPC'et, der er forbundet med forfærdelige sygdomme, og ved, hvor de er i strukturen, og hvordan de sammen kan hjælpe med at designe det næste sæt eksperimenter for at prøve at besvare spørgsmålene om, hvad disse mutationer gør."
'Dette elegante arrangement af spaghetti-nudler'
I den anden artikel, med titlen "Arkitektur af linker-stilladset i den nukleare pore," beskriver forskerholdet, hvordan det bestemte hele strukturen af det, der er kendt som NPC's linker-stillads - samlingen af proteiner, der hjælper med at holde NPC'en sammen samtidig med at den giver den den fleksibilitet, den har brug for til at åbne og lukke og tilpasse sig selv, så den passer til de molekyler, der passerer igennem.
Hoelz sammenligner NPC'en med noget, der er bygget af legoklodser, der passer sammen uden at låse sammen og i stedet er surret sammen af gummibånd, der holder dem for det meste på plads, mens de stadig tillader dem at bevæge sig lidt rundt.
"Jeg kalder disse ustrukturerede limstykker for 'porens mørke stof'," siger Hoelz. "Dette elegante arrangement af spaghetti nudler holder alt sammen."
Processen til at karakterisere strukturen af linker-stilladset var meget den samme som den proces, der blev brugt til at karakterisere de andre dele af NPC. Holdet fremstillede og rensede store mængder af de mange typer linker- og stilladsproteiner, brugte en række biokemiske eksperimenter og billeddannelsesteknikker til at undersøge individuelle interaktioner og testede dem stykke for stykke for at se, hvordan de passer sammen i den intakte NPC.
For at kontrollere deres arbejde introducerede de mutationer i generne, der koder for hver af disse linkerproteiner i en levende celle. Da de vidste, hvordan disse mutationer ville ændre de kemiske egenskaber og formen af et specifikt linkerprotein, hvilket gør det defekt, kunne de forudsige, hvad der ville ske med strukturen af cellens NPC'er, når disse defekte proteiner blev introduceret. Hvis cellens NPC'er var funktionelt og strukturelt defekte på den måde, de forventede, vidste de, at de havde det korrekte arrangement af linkerproteinerne.
"En celle er meget mere kompliceret end det simple system, vi skaber i et reagensglas, så det er nødvendigt at verificere, at resultater opnået fra in vitro eksperimenter holder in vivo," siger Petrovic.
Samlingen af NPC's ydre ansigt hjalp også med at løse et mangeårigt mysterium om atomhylsteret, det dobbelte membransystem, der omgiver kernen. Ligesom membranen i cellen, hvori kernen befinder sig, er kernemembranen ikke perfekt glat. Det er snarere spækket med molekyler kaldet integrale membranproteiner (IMP'er), som tjener i en række forskellige roller, herunder fungerer som receptorer og hjælper med at katalysere biokemiske reaktioner.
Selvom IMP'er kan findes på både indersiden og ydersiden af atomhylsteret, havde det været uklart, hvordan de faktisk rejste fra den ene side til den anden. Fordi IMP'er sidder fast inde i membranen, kan de faktisk ikke bare glide gennem den centrale transportkanal af NPC'en, ligesom fritsvævende molekyler gør.
Da Hoelz' team forstod strukturen af NPC's linker-stillads, indså de, at det tillader dannelsen af små "tagrender" rundt om dens yderkant, der tillader IMP'erne at glide forbi NPC fra den ene side af atomhylsteret til den anden, mens forbliver altid indlejret i selve membranen.
"Det forklarer en masse ting, der har været gådefulde på området. Jeg er meget glad for at se, at den centrale transportkanal faktisk har evnen til at udvide sig og danne sideporte for disse IMP'er, som vi oprindeligt havde foreslået for mere end ti år siden ," siger Hoelz.
Tilsammen repræsenterer resultaterne af de to artikler et spring fremad i videnskabsmænds forståelse af, hvordan den menneskelige NPC er bygget op, og hvordan den fungerer. Holdets opdagelser åbner døren for meget mere forskning. "Efter at have bestemt dens struktur, kan vi nu fokusere på at udarbejde de molekylære baser for NPC's funktioner, såsom hvordan mRNA bliver eksporteret og de underliggende årsager til de mange NPC-associerede sygdomme med det formål at udvikle nye terapier," siger Hoelz.
Artiklerne, der beskriver arbejdet, vises i 10. juni-udgaven af tidsskriftet Science . + Udforsk yderligere
Biokemikere løser strukturen af cellens DNA-gatekeeper
 Varme artikler
Varme artikler
-
 Biokompatibelt binært hologram med lægemiddel-elueringsfunktionera) grafisk repræsentation af driften af et binært hologram som en lægemiddelfrigivelsesindikator. Efterhånden som lægemiddelelueringen går, korrumperer fjernfeltsdiffraktionsmønstrene på en bestemt
Biokompatibelt binært hologram med lægemiddel-elueringsfunktionera) grafisk repræsentation af driften af et binært hologram som en lægemiddelfrigivelsesindikator. Efterhånden som lægemiddelelueringen går, korrumperer fjernfeltsdiffraktionsmønstrene på en bestemt -
 Forskere udvikler en ny tilgang til at forudsige, hvordan væsker fryserKredit:Pixabay/CC0 Public Domain Forskere fra Queen Mary University of London har udviklet en ny beregningsmetode til bedre at forstå frysning i forskellige typer væsker. Processen med at fryse,
Forskere udvikler en ny tilgang til at forudsige, hvordan væsker fryserKredit:Pixabay/CC0 Public Domain Forskere fra Queen Mary University of London har udviklet en ny beregningsmetode til bedre at forstå frysning i forskellige typer væsker. Processen med at fryse, -
 Ny polymermembranteknologi forbedrer effektiviteten af kuldioxidopsamlingKredit:Unsplash/CC0 Public Domain Forskere har udviklet en ny membranteknologi, der muliggør mere effektiv fjernelse af kuldioxid (CO2 ) fra blandede gasser, såsom emissioner fra kraftværker. For
Ny polymermembranteknologi forbedrer effektiviteten af kuldioxidopsamlingKredit:Unsplash/CC0 Public Domain Forskere har udviklet en ny membranteknologi, der muliggør mere effektiv fjernelse af kuldioxid (CO2 ) fra blandede gasser, såsom emissioner fra kraftværker. For -
 Vand skaber fælder i organisk elektronikTanvi Upreti, ph.d.-studerende ved afdelingen for komplekse materialer og anordninger, som udførte eksperimenterne sammen med den første forfatter, Guangzheng Zuo. Kredit:Charlotte Perhammar Organ
Vand skaber fælder i organisk elektronikTanvi Upreti, ph.d.-studerende ved afdelingen for komplekse materialer og anordninger, som udførte eksperimenterne sammen med den første forfatter, Guangzheng Zuo. Kredit:Charlotte Perhammar Organ
- Udvandringen fra Vanuatu-øerne fortsætter, selvom vulkanen stabiliserer sig
- Vurdering af virkningen af tabsmekanismer i solcellekandidat antimonsulfidselenid
- Kemikere lykkes med syntese af aminoalkoholer ved at udnytte lys
- Højteknologisk overvågning forstærker politiets bias og overreach
- Gravitationsbølgedetektorer kunne kaste lys over mørkt stof
- Sådan laver du Saturns Rings for Science Projects


