Nye proteinstrukturer for at hjælpe rationelt lægemiddeldesign
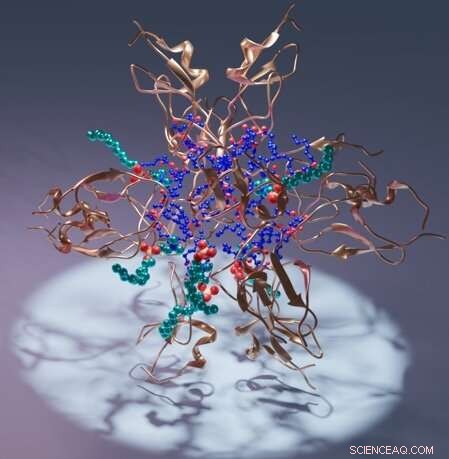
Kunstnerisk gengivelse af et proteinkinase C C1-domæne (kobber), dets ligand diacylglycerol (blå) og detergent (cyan). Kredit:Sachin Katti.
Som et stort fremskridt for rationelt lægemiddeldesign har et Texas A&M AgriLife-team beskrevet adskillige proteinstrukturer af en afgørende aktør i cellulære processer. Fremskridtet kunne bringe nye ideer til behandling af sygdomme som Alzheimers, AIDS, kræft og andre.
Konkret beskriver arbejdet C1-domænet af proteinkinase C, PKC, som hjælper med at regulere proteinets aktivitet i organismer. I strukturerne omslutter C1-domænet forskellige molekyler af intens terapeutisk interesse, hvilket giver den første pålidelige guide til atomopløsning til at designe lægemiddelkandidater.
Udgivet 16. maj i Nature Communications , blev forskningen ledet af Tatyana Igumenova, Ph.D., lektor i Institut for Biokemi og Biofysik i Texas A&M College of Agriculture and Life Sciences. Projektets primære forfatter er Sachin Katti, Ph.D., en postdoc, der arbejder med Igumenova.
Undersøgelsen involverede et samarbejde med Inna Krieger, Ph.D., forskningsadjunkt, og James Sacchettini, Ph.D., professor, begge i Institut for Biokemi og Biofysik.
En af de mest eftertragtede proteinstrukturer
En sund celle reagerer på kemiske signaler på præcise, indviklede måder. At modtage kemiske input fra cellens miljø og videresende dem til de centrale kontrolsystemer i cellekernen er opgaven for specialiserede proteiner såsom PKC.
Ukorrekt PKC-aktivitet viser sig i mange menneskelige sygdomme. Som følge heraf er der stor interesse for at finde måder at finjustere PKC-aktivitet med lægemidler. Designet af sådanne lægemidler vil tilbyde nye tilgange til behandling af Alzheimers sygdom, AIDS, kræft og mere.
"Proteinkinase C er et af de mest intenst undersøgte proteiner inden for cellebiologi og farmakologi," sagde Igumenova. "En stor hindring har været manglen på præcise strukturelle oplysninger til at vejlede indsatsen for lægemiddeldesign."
En komplikation for lægemiddeldesign er, at PKC-familien har 11 medlemmer. Forskellige PKC-familiemedlemmer kan have modsatte fysiologiske virkninger, så en succesfuld lægemiddelkandidat skal være selektiv med hensyn til, hvilken PKC den er målrettet mod.
For at gøre det skal lægemiddelkandidater passe en mål-PKC som en nøgle til en lås. Men det har ikke været let at bestemme 3D-strukturen af en PKC "on-switch" - C1-domænet - bundet til PKC-aktivatorer.
Proteinstrukturer løses typisk ved hjælp af røntgenkrystallografi. Teknikken går ud på at bruge røntgenstråler til at bestemme positionen af atomer i en krystal. Til denne metode skal forskerne skabe betingelser, hvor proteinet af interesse krystalliserer. Alligevel lykkedes det ikke med intens indsats i mange forskningslaboratorier i de sidste tre årtier at give krystaller af C1-domæner bundet til relevante ligander. På grund af denne mangel på fremskridt erklærede flere forskere opgaven umulig, sagde Igumenova.

Krystaller af et domæne af proteinkinase C dannet spontant i Kattis NMR-prøverør. Kredit:Sachin Katti.
Løsning af et 30-årigt problem
Da de accepterede problemet som udfordrende, besluttede Katti og Igumenova i stedet at studere molekylerne i opløsning ved hjælp af nuklear magnetisk resonans, NMR, spektroskopi. Dette involverede at finde de rigtige komponenter til at efterligne cellemembraner, hvor C1-domænet ville støde på ligander.
"Så, en skønne dag, opdagede Sachin, at der dannedes krystaller i et gammelt NMR-rør," sagde Igumenova. "Jeg giver al æren til Sachin, som dybest set sagde:"Jeg vil gå og teste dem og se, om de faktisk er proteinet." Og han havde ret. Det gav os tillid til, at krystallisering er mulig."
Til gengæld giver Katti tillid til den indsigt, der er opnået fra NMR, og en smule held.
"Jeg tror, det er skønheden ved at lave forskning, hvor du skal bruge flere tilgange," sagde han. "Du ved aldrig, hvornår en tilgang vil være nyttig til at gøre noget med andre tilgange."
Indsigt fra NMR og røntgenkrystallografi
De nye proteinstrukturer har sammen med holdets NMR-resultater allerede givet interessant information. Et mangeårigt mysterium har været, hvordan C1-domæner kan rumme ligander, der har meget forskellige kemiske strukturer, sagde Igumenova.
"Vores tidligere NMR-arbejde viste, at løkkerne i C1-domænet, der binder ligander, er meget dynamiske," sagde Igumenova. "Dette C1-domæne er som en PAC-mand. Det binder membranen, og derefter søger det efter en ligand. Når det først finder liganden, låses det på."
Derudover viser strukturen, at den ligandbindende rille har en "vandelskende" eller hydrofil overflade i bunden og "vandafvisende" eller hydrofob overflade øverst.
"Hvis du tænker på et lipidmolekyle, er hovedgruppen hydrofil, og halen er hydrofob," sagde Igumenova. "Så når C1-domæner binder lipidligander, matcher mønstrene."
Holdets resultater inkluderer strukturen af et C1-domæne bundet til dets naturlige ligand, diacylglycerol. Derudover beskriver teamet adskillige andre strukturer af C1, der inkluderer forskellige forbindelser af farmakologisk interesse.
Arbejdet giver også en metode til at teste forskellige lægemiddelkandidater, sagde Katti.
"Hvis du vil studere fisk, vil du studere dem i vand," sagde Katti. "Nu ved vi, hvordan man skaber et membranlignende miljø, hvor disse meget hydrofobe forbindelser kan testes for C1-binding."
Dernæst planlægger Katti og Igumenova at udforske C1-domæner fra andre PKC-familiemedlemmer.
"Det er vigtigt for os at fokusere på C1-domæner, fordi de har iboende forskelle, som kan udnyttes til at opnå selektivitet," sagde Igumenova. "Det, vi finder nu, er, at ikke alle C1-domæner er skabt lige." + Udforsk yderligere
Resultater afslører en ny aktiveringsmekanisme for ALK
 Varme artikler
Varme artikler
-
 Ny mikroskopi virker ved ekstrem varme, kaster lys over legeringer til atomreaktorerAfsaneh Rabiei er her afbilledet med den enhed, hun udviklede, der kan fange scanning elektronmikroskopi (SEM) billeder i realtid ved temperaturer op til 1, 000 grader Celsius, mens der påføres spændi
Ny mikroskopi virker ved ekstrem varme, kaster lys over legeringer til atomreaktorerAfsaneh Rabiei er her afbilledet med den enhed, hun udviklede, der kan fange scanning elektronmikroskopi (SEM) billeder i realtid ved temperaturer op til 1, 000 grader Celsius, mens der påføres spændi -
 Rå æg & eddike eksperimenterVidenskabseksperimenter med rå æg og eddike kan være en sjov og interessant måde for børn og studerende at lære om kemiske reaktioner og osmose. Eddike bruges til at skabe en kemisk reaktion med rå
Rå æg & eddike eksperimenterVidenskabseksperimenter med rå æg og eddike kan være en sjov og interessant måde for børn og studerende at lære om kemiske reaktioner og osmose. Eddike bruges til at skabe en kemisk reaktion med rå -
 Digitalt kemi -gennembrud gør ord til molekylerKredit:OpenClipartVectors, CC0 Public Domain Et nyt system, der automatisk kan omdanne ord til molekyler efter behov, åbner digitaliseringen af kemi, siger forskere. Forskere fra University of
Digitalt kemi -gennembrud gør ord til molekylerKredit:OpenClipartVectors, CC0 Public Domain Et nyt system, der automatisk kan omdanne ord til molekyler efter behov, åbner digitaliseringen af kemi, siger forskere. Forskere fra University of -
 Ny bøjelig smartphone-teknologi kan bruge overvågning til at redde patienters livPurdue University-forskere arbejder på at bruge en ny polymerfilm, som kunne gøre smartphones mere bøjelige, at skabe skræddersyede sensorer, der ikke-invasivt kunne overvåge glukoseniveauer, hjertefr
Ny bøjelig smartphone-teknologi kan bruge overvågning til at redde patienters livPurdue University-forskere arbejder på at bruge en ny polymerfilm, som kunne gøre smartphones mere bøjelige, at skabe skræddersyede sensorer, der ikke-invasivt kunne overvåge glukoseniveauer, hjertefr
- Nyt partnerskab hjælper med bæredygtig vækst med jordobservationer
- Forargelse efter at Kirgisistan genbegraver sin eneste gamle mumie
- Forskere løser et 50 år gammelt enzymmysterium
- For at spare energi, AI rydder op i overskyede vejrudsigter
- Ja, mennesker udtømmer jordens ressourcer, men fodaftryksvurderinger fortæller ikke hele historien
- Genovervejer elektronikaffaldsproblemet


