Teoretisk perspektiv på C-H/O-H-aktivering af Cu-O i biologiske og syntetiske systemer
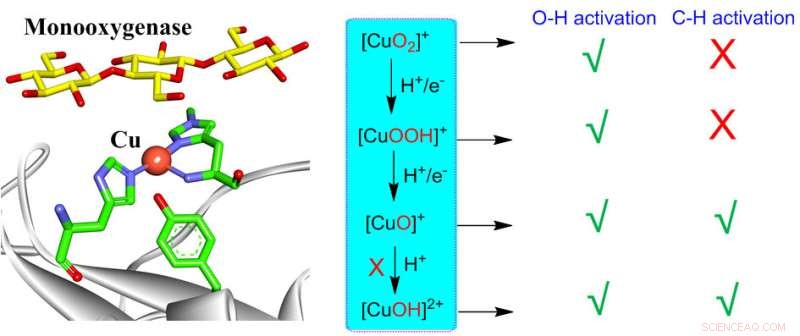
Dioxygenaktivering med mononukleært kobber i biologiske og syntetiske systemer kan generere forskellige kobber-oxygen-mellemprodukter, herunder [CuO2 ] + , [CuOOH] + , [CuO] + , [CuOH] 2+ . Alle disse arter er i stand til at udføre O-H-aktivering, mens kun [CuO] + og [CuOH] 2+ er reaktive for CH-aktivering. Men dannelsen af [CuOH] 2+ er yderst ugunstig i monooxygenaser, hvilket efterlader [CuO] + som det eneste aktive mellemprodukt, der er ansvarligt for CH-aktivering i monooxygenaser. Disse indsigter kan give en ensartet forståelse af reaktiviteter af forskellige kobber-ilt aktive arter i biologiske og syntetiske systemer. Kredit:Chinese Journal of Catalysis
Dioxygenaktiveringer udgør et af kernespørgsmålene i kobberafhængige metalloenzymer. Ved O2 aktivering, kobberafhængige metalloenzymer, herunder partikelformige methanmonooxygenaser (pMMO'er), lytiske polysaccharidmonooxygenaser (LPMO'er) og binukleære kobberenzymer PHM og DBM, er i stand til at udføre udfordrende C-H/O-H-bindingsaktiveringer.
I mellemtiden er kobber-oxygen-kerneholdige komplekser blevet syntetiseret for at efterligne den aktive art af metalloenzymer. Dioxygenaktivering ved mononukleært kobberaktivt sted kan generere kobber-oxygen-mellemprodukter, herunder Cu(II)-superoxo, Cu(II)-hydroperoxo, Cu(II)-oxyl såvel som Cu(III)-hydroxidarterne.
Spændende nok er alle disse arter blevet påberåbt som de potentielle aktive mellemprodukter for C-H/O-H-aktiveringer i enten biologiske eller syntetiske systemer. På grund af den dårlige forståelse af kobber-ilt-kompleksets reaktivitet er arten af aktive arter i både biologiske og syntetiske systemer meget kontroversielle.
For nylig målte et forskerhold ledet af prof. Binju Wang fra Xiamen University, Kina, reaktiviteten af forskellige mononukleære kobber-iltarter i både biologiske systemer og de syntetiske systemer. Undersøgelsen viser:
- (a) MN15-funktionen er meget nøjagtig for mononukleære kobber-oxygen-komplekser, hvori den eksperimentelle kinetik af forskellige C-H/O-H-aktiveringer godt kan reproduceres med MN15.
- (b) Cu(II)-superoxo viser de konsistente reaktiviteter i både biologiske og syntetiske systemer:Det er meget reaktivt for O-H-bindingsaktiveringer, men viser lave reaktiviteter for CH-bindingsaktiveringer. Cu(II)-superoxo kunne således ikke være den aktive art for CH-aktiveringer i både biologiske og syntetiske systemer.
- (c) Cu(II)-hydroperoxo er inert for C-H-bindingsaktiveringer, men dens radikale karakter på det proksimale O gør det i stand til at udføre HAA fra moderate O-H-bindinger eller koble sig med en anden Cu(I) for at danne den dinukleære kobberart . Således repræsenterer Cu(II)-hydroperoxo et nøglemellemprodukt langs O2 aktiveringsveje frem for en oxidant til CH-aktivering i både biologiske og syntetiske systemer.
- (d) Cu(II)-oxyl er yderst reaktivt for CH-bindingsaktiveringer og kan således være ansvarlig for CH-aktivering i mononukleære kobbermonoxygenaser.
- (e) Selvom kobber(III)-hydroxids høje reaktivitet mod aktivering af CH-bindinger er veletableret, er dannelsen af sådanne arter i monoxygenaser yderst ugunstig termodynamisk.
Disse indsigter forventes at give den konsekvente forståelse af reaktiviteter af forskellige kobber-ilt aktive arter i både biologiske og syntetiske systemer.
Anmeldelsen blev offentliggjort i Chinese Journal of Catalysis . + Udforsk yderligere
Forskere afslører mekanisme for dioxygenaktivering
Sidste artikelLærende kemiske netværk giver livet et chiralt twist
Næste artikelAvanceret materialevidenskab til superledende kvantekredsløb
 Varme artikler
Varme artikler
-
 Når kemi med grønt lys efterligner, hvad der sker i livetKredit:Unsplash/CC0 Public Domain Forskere ser ofte på, hvordan molekyler opfører sig i naturen for at hjælpe dem med at designe kemiske processer, og det er, hvad forskere fra QUT og Gent Univers
Når kemi med grønt lys efterligner, hvad der sker i livetKredit:Unsplash/CC0 Public Domain Forskere ser ofte på, hvordan molekyler opfører sig i naturen for at hjælpe dem med at designe kemiske processer, og det er, hvad forskere fra QUT og Gent Univers -
 De fleste proteinoplysninger, der nogensinde er fanget fra en enkelt celle takket være ny nanoPOTS-…Chippen, der indeholder flere brønde, hvor proteiner fra enkelte celler adskilles til yderligere analyse. Kredit:PNNL Forskere har fået en række nøgleoplysninger om proteiner, alle cellers molekyl
De fleste proteinoplysninger, der nogensinde er fanget fra en enkelt celle takket være ny nanoPOTS-…Chippen, der indeholder flere brønde, hvor proteiner fra enkelte celler adskilles til yderligere analyse. Kredit:PNNL Forskere har fået en række nøgleoplysninger om proteiner, alle cellers molekyl -
 Kræftceller kan kommunikere over længere afstande i kroppenKredit:Ecole Polytechnique Federale de Lausanne EPFL-forskere har opdaget, at kræftceller bruger exosomer til at kommunikere med hinanden og sende information gennem blodbanen. Dette gennembrud åb
Kræftceller kan kommunikere over længere afstande i kroppenKredit:Ecole Polytechnique Federale de Lausanne EPFL-forskere har opdaget, at kræftceller bruger exosomer til at kommunikere med hinanden og sende information gennem blodbanen. Dette gennembrud åb -
 Billede:PlastgranskovKredit:SEBA science team og E-USOC Dette billede viser, hvordan en metallegering kunne se ud, når den størkner - ved at bruge en gennemsigtig organisk blanding som stand-in for metaller. Sammenlig
Billede:PlastgranskovKredit:SEBA science team og E-USOC Dette billede viser, hvordan en metallegering kunne se ud, når den størkner - ved at bruge en gennemsigtig organisk blanding som stand-in for metaller. Sammenlig
- Hvordan beregner jeg Molaritet?
- ZTE anmoder den amerikanske regering om at ophæve sanktionerne
- Eksperimentel vaccine sløver den dødeligste af syntetiske opioider
- Diamanter er for evigt - uanset om de er fremstillet i et laboratorium eller udvindes fra jorden
- Sådan beregnes KVA fra den elektriske regning
- Lille størrelse - stort potentiale


