Hvordan ens ladninger i enzymer styrer biokemiske reaktioner
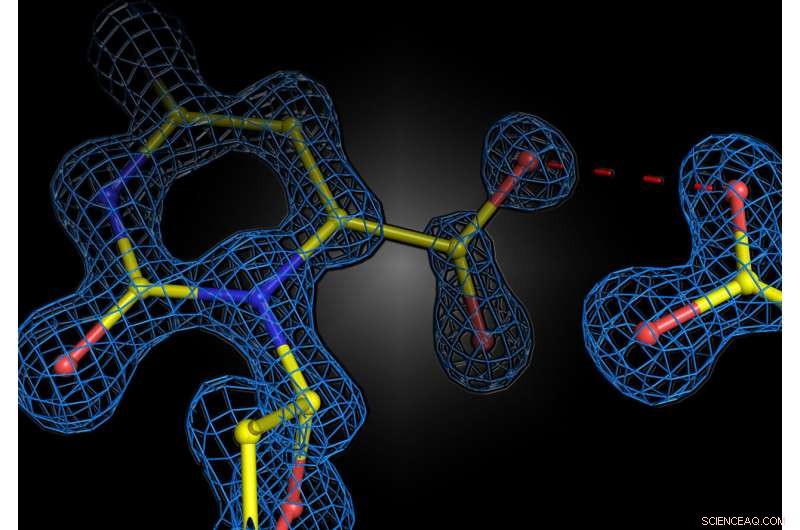
Strukturelt øjebliksbillede af enzymreaktionen i det humane enzym orotidin 5'-phosphat decarboxylase. De to negative ladninger af substratet og enzymet frastøder ikke hinanden, men danner en attraktiv interaktion. Kredit:Kai Tittmann
Det er velkendt i fysik og kemi, at lige ladninger frastøder hinanden, mens modsatte ladninger tiltrækker. Man har længe antaget, at dette princip også gælder, når enzymer - de biologiske katalysatorer i alle levende organismer - danner eller bryder kemiske bindinger. Man troede, at enzymer placerer ladninger i deres "aktive centre", hvor de kemiske reaktioner faktisk finder sted, på en sådan måde, at de frastøder lignende ladninger fra de andre molekyler omkring dem. Dette koncept er kendt som "elektrostatisk stress." For eksempel, hvis substratet (stoffet, som enzymet virker på) bærer en negativ ladning, kunne enzymet bruge en negativ ladning til at "stresse" substratet og dermed lette reaktionen. En ny undersøgelse fra universitetet i Göttingen og Max Planck Institute for Multidisciplinary Sciences i Göttingen har dog nu vist, at to lige store ladninger mod forventning ikke nødvendigvis fører til frastødning, men kan forårsage tiltrækning i enzymer. Resultaterne blev offentliggjort i tidsskriftet Nature Catalysis .
Holdet undersøgte et velkendt enzym, som er blevet grundigt undersøgt og er et lærebogseksempel på enzymkatalyse. Uden enzymet er reaktionen ekstremt langsom:faktisk ville det tage 78 millioner år for halvdelen af substratet at reagere. Enzymet accelererer denne reaktion med 10 17 gange, blot ved at placere negative og positive ladninger i det aktive center. Da substratet indeholder en negativt ladet gruppe, der spaltes som kuldioxid, har man i årtier antaget, at enzymets negative ladninger tjener til at stresse substratet, som også er negativt ladet, og accelerere reaktionen. Denne hypotetiske mekanisme forblev dog ubevist, fordi strukturen af reaktionen var for hurtig til at kunne observeres.
Professor Kai Tittmanns gruppe ved Göttingen Center for Molecular Biosciences (GZMB) er nu for første gang lykkedes med at bruge proteinkrystallografi til at få et strukturelt øjebliksbillede af substratet kort før den kemiske reaktion. Uventet afviste de negative ladninger af enzym og substrat ikke hinanden. I stedet delte de en proton, som fungerede som en slags molekylær lim i et attraktivt samspil. "Spørgsmålet om, hvorvidt to lige ladninger er venner eller fjender i forbindelse med enzymkatalyse, har længe været kontroversielt inden for vores felt, og vores undersøgelse viser, at de grundlæggende principper for, hvordan enzymer virker, stadig er langt fra at blive forstået," siger Tittmann . De krystallografiske strukturer blev analyseret af kvantekemiker professor Ricardo Mata og hans team fra Göttingen Universitets Institut for Fysisk Kemi. "Den ekstra proton, som har en positiv ladning, mellem de to negative ladninger bruges ikke kun til at tiltrække det molekyle, der er involveret i reaktionen, men det udløser en kaskade af protonoverførselsreaktioner, der yderligere accelererer reaktionen," forklarer Mata.
"Vi tror på, at disse nybeskrevne principper for enzymkatalyse vil hjælpe med udviklingen af nye kemiske katalysatorer," siger Tittmann. "Da enzymet, vi undersøgte, frigiver kuldioxid, den vigtigste drivhusgas produceret af menneskelige aktiviteter, kan vores resultater hjælpe med at udvikle nye kemiske strategier til kuldioxidfiksering." + Udforsk yderligere
Hybride enzymkatalysatorer syntetiseret ved en de novo-tilgang til udvidelse af biokatalyse
 Varme artikler
Varme artikler
-
 Hurtig, præcis måde at kontrollere jordnøddeplanter for sunde egenskaberLee Sanchez, medforfatter og biokemi kandidatstuderende, tager jordnøddeprøver til undersøgelsen. Kredit:Dmitry Kurouski Den langvarige proces med at avle bedre jordnøddeplanter kan fremskyndes ve
Hurtig, præcis måde at kontrollere jordnøddeplanter for sunde egenskaberLee Sanchez, medforfatter og biokemi kandidatstuderende, tager jordnøddeprøver til undersøgelsen. Kredit:Dmitry Kurouski Den langvarige proces med at avle bedre jordnøddeplanter kan fremskyndes ve -
 Usædvanlig halvmetal viser tegn på unikke overfladeledningstilstandeKredit:Masaki Uchida Forskere ved Tokyo Institute of Technology kontrollerer eksperimentelt eksistensen af eksotiske overfladeledningstilstande i topologiske semimetaller (TSMer), materialer, de
Usædvanlig halvmetal viser tegn på unikke overfladeledningstilstandeKredit:Masaki Uchida Forskere ved Tokyo Institute of Technology kontrollerer eksperimentelt eksistensen af eksotiske overfladeledningstilstande i topologiske semimetaller (TSMer), materialer, de -
 Hvad sker der med atomer under en kemisk reaktion?Kemiske reaktioner finder sted, når atomerne i to eller flere stoffer udveksler eller deler elektroner. Reaktionen producerer atomer og molekyler med elektronerne arrangeret forskelligt. Den ændrede k
Hvad sker der med atomer under en kemisk reaktion?Kemiske reaktioner finder sted, når atomerne i to eller flere stoffer udveksler eller deler elektroner. Reaktionen producerer atomer og molekyler med elektronerne arrangeret forskelligt. Den ændrede k -
 Stivelse kan erstatte almindelig plast i fødevareemballageKredit:Karlstad Universitet På sigt skal alt petroleumsbaseret materiale i fødevareemballage erstattes med biobaseret materiale. Forskning udført ved Karlstad Universitet viser, at en blanding af
Stivelse kan erstatte almindelig plast i fødevareemballageKredit:Karlstad Universitet På sigt skal alt petroleumsbaseret materiale i fødevareemballage erstattes med biobaseret materiale. Forskning udført ved Karlstad Universitet viser, at en blanding af
- Video:Mod nul sult på verdensplan
- Ny finansiering til forskning i supermateriale grafen
- Flodhesteaffald forårsager fiskedrab i Afrikas Mara-flod
- Forskel mellem tilføjelse af maskine og kalkulator
- Med en blid berøring, forskere skubber os tættere på flashhukommelses efterfølger
- Ny mekanisme muliggør lavere energibehov til OLED -skærme


