Reversibel kemoenzymatisk mærkningsstrategi muliggør dybdegående analyse af protein O-GlcNAcylering
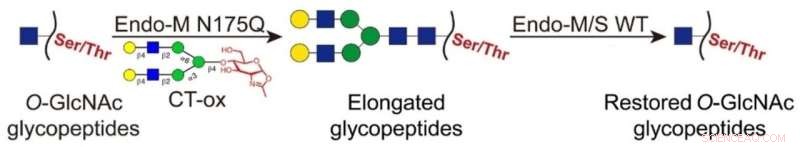
Kredit:Angewandte Chemie (2022). DOI:10.1002/ange.202117849
O-bundet β-N-acetylglucosamin (O-GlcNAcylation), en vigtig post-translationel modifikation (PTM) af proteiner, er involveret i forskellige biologiske funktioner.
Den reversible modifikation af O-GlcNAc giver on-off proteinfunktioner under biologiske processer. Aberrationer af O-GlcNAcylering er tæt forbundet med mange stofskiftesygdomme sammen med invasionen og metastasen af flere tumorer.
For nylig har et forskerhold ledet af prof. Ye Mingliang og prof. Qin Hongqiang fra Dalian Institute of Chemical Physics (DICP) ved det kinesiske videnskabsakademi (CAS) i samarbejde med prof. Huang Wei fra Shanghai Institute of Materia Medica af CAS, udviklede en ny strategi for reversibel kemoenzymatisk mærkning af O-GlcNAc-glycopeptider, som muliggjorde dybdegående analyse af protein O-GlcNAcylering.
Deres resultater blev offentliggjort i Angewandte Chemie den 14. marts.
For at muliggøre proteom-dækkende analyse af O-GlcNAcylering er det vigtigt at berige glycopeptider selektivt fra fordøjelsen af komplekse prøver.
Mange forskere har søgt berigelse af O-GlcNAcylerede peptider før analyse ved væskekromatografi med tandem massespektrometri (LC-MS/MS). Imidlertid lider de fleste af tilgangene af svag bindingsaffinitet eller voluminøse tags, som interfererer med berigelsen og identifikationen af O-GlcNAcylerede peptider.
I denne nyudviklede strategi blev O-GlcNAc-delene ligeret med lange N-glycaner under anvendelse af en Endo-M-mutant, som muliggjorde berigelse af de mærkede glycopeptider ved hydrofil interaktionsvæskekromatografi (HILIC). Derefter blev de vedhæftede glycaner på de berigede glycopeptider fjernet med vildtype Endo-M/S for at genoprette O-GlcNAc-delen.
Sammenlignet med den klassiske kemoenzymatiske mærkning muliggjorde denne tilgang tag-fri identifikation og eliminerede interferensen af voluminøse tags i glycopeptiddetektion.
Ved at bruge denne metode identificerede forskerne desuden 657 potentielle O-GlcNAc-glykosider fra kun 0,4 mg HeLa-cellekerneproteiner, hvilket kun var nødvendigt med 1/10 af proteinprøver til en sammenlignelig O-GlcNAcyleringsanalyse, hvilket indikerer den høje følsomhed af dette metode.
I alt identificerede de 1.414 glykosider fra kun 1,1 mg proteinprøver, og 45 % af dem var ikke inkluderet i O-GlcNAcAltas af alle menneskelige prøver i de sidste 35 år, hvilket forbedrede analysedækningen af protein O-GlcNAcylering.
"Denne tag-fri berigelse strategi repræsenterer en unik mulighed for proteom-dækkende analyse af O-GlcNAcylation og fremmer mekanisme undersøgelser," sagde Prof. Ye. + Udforsk yderligere
De molekylære mekanismer ved Alzheimers
 Varme artikler
Varme artikler
-
 Oprindelsen af bismag i løgKredit:American Chemical Society At hakke løg er normalt forbundet med vandige og stikkende øjne. Men efter at løgene er skåret i tern og tårerne er tørret, grøntsagsstykkerne kan nogle gange udvi
Oprindelsen af bismag i løgKredit:American Chemical Society At hakke løg er normalt forbundet med vandige og stikkende øjne. Men efter at løgene er skåret i tern og tårerne er tørret, grøntsagsstykkerne kan nogle gange udvi -
 Forskelle mellem petroleumsether & diethyl EtherDe lignende navne på petroleumsether og diethylether er en hyppig kilde til forvirring i laboratorier og andre steder, der bruger kemikalier. På trods af den almindelige ether -betegnelse er disse to
Forskelle mellem petroleumsether & diethyl EtherDe lignende navne på petroleumsether og diethylether er en hyppig kilde til forvirring i laboratorier og andre steder, der bruger kemikalier. På trods af den almindelige ether -betegnelse er disse to -
 Metalinnovation tilbyder en unik, omkostningseffektiv mulighed for VVS- og fremstillingsindustrierEn ny innovation af kobber-manganlegering fra Purdue University tilbyder en unik mulighed for VVS- og fremstillingsindustrien. Kredit:Purdue University En opdagelse foretaget af forskere for at si
Metalinnovation tilbyder en unik, omkostningseffektiv mulighed for VVS- og fremstillingsindustrierEn ny innovation af kobber-manganlegering fra Purdue University tilbyder en unik mulighed for VVS- og fremstillingsindustrien. Kredit:Purdue University En opdagelse foretaget af forskere for at si -
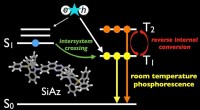 Spændende tider for effektiv, tung-atom-fri OLED'erFigur 1:Strukturen af udviklet stuetemperatur-phosphorescensmateriale (SiAz) og illustrativt resumé af dette arbejde. Kredit:Osaka University Organic light-emitting diode (OLED)-skærme er nu meg
Spændende tider for effektiv, tung-atom-fri OLED'erFigur 1:Strukturen af udviklet stuetemperatur-phosphorescensmateriale (SiAz) og illustrativt resumé af dette arbejde. Kredit:Osaka University Organic light-emitting diode (OLED)-skærme er nu meg
- Forskere hævder, at de nuværende klimaforandringsmodeller undervurderer problemet
- International konkurrence benchmarks metagenomics software
- Et kig inde i neurale netværk
- Billede:Hubble ser en stjerneovn
- Klare søer dækker forringet vandkvalitet
- Undersøgelse viser, at byer kan overveje race og indkomst i husholdningernes energieffektivitetspro…


