Ved at lytte lærer forskerne, hvordan et protein folder

Ved at konvertere deres data til lyde opdagede forskerne, hvordan brintbindinger bidrager til de lynhurtige bevægelser, der omdanner en række aminosyrer til et funktionelt, foldet protein.
Deres rapport, offentliggjort i Proceedings of the National Academy of Sciences, giver et hidtil uset billede af rækkefølgen af hydrogenbindingsbegivenheder, der opstår, når et protein omdannes fra en udfoldet til en foldet tilstand.
"Et protein skal foldes ordentligt for at blive et enzym eller et signalmolekyle eller hvad dets funktion end måtte være - alle de mange ting, som proteiner gør i vores kroppe," sagde University of Illinois Urbana-Champaign kemiprofessor Martin Gruebele, der ledede den nye forskning med komponist og softwareudvikler Carla Scaletti.
Fejlfoldede proteiner bidrager til Alzheimers sygdom, Parkinsons sygdom, cystisk fibrose og andre lidelser. For bedre at forstå, hvordan denne proces går skævt, skal forskerne først bestemme, hvordan en række aminosyrer formskifter til sin endelige form i cellens vandige miljø. De faktiske transformationer sker meget hurtigt, "et sted mellem 70 nanosekunder og to mikrosekunder," sagde Gruebele.
Hydrogenbindinger er relativt svage attraktioner, der justerer atomer placeret på forskellige aminosyrer i proteinet. Et foldeprotein vil danne en række hydrogenbindinger internt og med de vandmolekyler, der omgiver det. I processen vrikker proteinet ind i utallige potentielle mellemkonformationer, nogle gange rammer det en blindgyde og går tilbage, indtil det snubler ind på en anden vej.
Proteinsonificering:Hårnål i en fælde
Forskerne ønskede at kortlægge tidssekvensen af hydrogenbindinger, der opstår, når proteinet folder. Men deres visualiseringer kunne ikke fange disse komplekse begivenheder.
"Der er bogstaveligt talt titusindvis af disse interaktioner med vandmolekyler under den korte passage mellem den udfoldede og foldede tilstand," sagde Gruebele.
Så forskerne vendte sig til data sonificering, en metode til at konvertere deres molekylære data til lyde, så de kunne "høre" brintbindingerne dannes. For at opnå dette skrev Scaletti et softwareprogram, der tildelte hver brintbinding en unik tonehøjde. Molekylære simuleringer genererede de essentielle data, der viste, hvor og hvornår to atomer var i den rigtige position i rummet – og tæt nok på hinanden – til at binde hydrogen.
Hvis de korrekte betingelser for binding fandt sted, spillede softwareprogrammet en tonehøjde svarende til den binding. Alt i alt sporede programmet hundredtusindvis af individuelle hydrogenbindingshændelser i rækkefølge.
Brug af lyd til at udforske hydrogenbindingsdynamikken under proteinfoldning
Talrige undersøgelser tyder på, at lyd behandles omtrent dobbelt så hurtigt som visuelle data i den menneskelige hjerne, og mennesker er bedre i stand til at opdage og huske subtile forskelle i en sekvens af lyde, end hvis den samme sekvens er repræsenteret visuelt, sagde Scaletti.
"I vores auditive system er vi virkelig meget indstillet på små forskelle i frekvens," sagde hun. "Vi bruger f.eks. frekvenser og kombinationer af frekvenser til at forstå tale."
Et protein tilbringer det meste af sin tid i foldet tilstand, så forskerne fandt også på en "sjældenhedsfunktion" til at identificere, hvornår de sjældne, flygtige øjeblikke med foldning eller udfoldning fandt sted.
De resulterende lyde gav dem indsigt i processen og afslørede, hvordan nogle brintbindinger ser ud til at fremskynde foldningen, mens andre ser ud til at bremse den. De karakteriserede disse overgange, idet de kaldte den hurtigste "motorvej", den langsomste "slyngede" og de mellemliggende for "tvetydige."
At inkludere vandmolekylerne i simuleringerne og hydrogenbindingsanalysen var afgørende for at forstå processen, sagde Gruebele.
"Halvdelen af energien fra en proteinfoldningsreaktion kommer fra vandet og ikke fra proteinet," sagde han. "Vi lærte virkelig ved at lave sonificering, hvordan vandmolekyler sætter sig på det rigtige sted på proteinet, og hvordan de hjælper proteinets konformation til at ændre sig, så det til sidst bliver foldet."
Mens hydrogenbindinger ikke er den eneste faktor, der bidrager til proteinfoldning, stabiliserer disse bindinger ofte en overgang fra en foldet tilstand til en anden, sagde Gruebele. Andre hydrogenbindinger kan midlertidigt hindre korrekt foldning. For eksempel kan et protein blive hængt op i en gentagende løkke, der involverer en eller flere hydrogenbindinger, der dannes, brydes og dannes igen - indtil proteinet til sidst undslipper denne blind vej for at fortsætte sin rejse til sin mest stabile foldede tilstand.
"I modsætning til visualiseringen, der ligner et totalt tilfældigt rod, hører du faktisk mønstre, når du lytter til dette," sagde Gruebele. "Dette er de ting, der var umulige at visualisere, men det er nemt at høre."
Flere oplysninger: Scaletti, Carla et al, Hydrogenbindingsheterogenitet korrelerer med proteinfoldningsovergangstilstandens passagetid som afsløret ved datasonificering, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2319094121. doi.org/10.1073/pnas.2319094121
Journaloplysninger: Proceedings of the National Academy of Sciences
Leveret af University of Illinois at Urbana-Champaign
 Varme artikler
Varme artikler
-
 Omskrivning af det periodiske system ved højtrykMartin Rahm fra Chalmers Tekniske Universitet præsenterer en ny undersøgelse, som kortlægger, hvordan grundstoffers egenskaber ændrer sig under pres. Forskningen tilbyder materialeforskere et helt nyt
Omskrivning af det periodiske system ved højtrykMartin Rahm fra Chalmers Tekniske Universitet præsenterer en ny undersøgelse, som kortlægger, hvordan grundstoffers egenskaber ændrer sig under pres. Forskningen tilbyder materialeforskere et helt nyt -
 Forskere rapporterer om ny klasse af polyethylenkatalysatorerOlafs Daugulis, Robert A. Welch Chair of Chemistry ved University of Houston, ledet et team, der opdagede en ny klasse af katalysatorer til fremstilling af ultra-højvægts polyethylen. Kredit:Universit
Forskere rapporterer om ny klasse af polyethylenkatalysatorerOlafs Daugulis, Robert A. Welch Chair of Chemistry ved University of Houston, ledet et team, der opdagede en ny klasse af katalysatorer til fremstilling af ultra-højvægts polyethylen. Kredit:Universit -
 Ny tilgang inden for organisk kemi gør det muligt at tilføje bor til molekyler med høj præcisionEn simpel chloridkatalysator muliggør selektiv CH-borylering under milde fotokemiske forhold. Kredit:University of Bristol Et hovedmål inden for organisk syntese er at udvikle effektive reaktioner
Ny tilgang inden for organisk kemi gør det muligt at tilføje bor til molekyler med høj præcisionEn simpel chloridkatalysator muliggør selektiv CH-borylering under milde fotokemiske forhold. Kredit:University of Bristol Et hovedmål inden for organisk syntese er at udvikle effektive reaktioner -
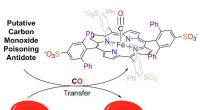 Lås op for en kur mod kulilteforgiftningEn voluminøs, vandopløselig jern-porphyrinforbindelse er blevet fremstillet, som binder CO, sekvestrerer CO fra COHb og redder CO-forgiftede røde blodlegemer. Som sådan kan det tjene som grundlag for
Lås op for en kur mod kulilteforgiftningEn voluminøs, vandopløselig jern-porphyrinforbindelse er blevet fremstillet, som binder CO, sekvestrerer CO fra COHb og redder CO-forgiftede røde blodlegemer. Som sådan kan det tjene som grundlag for
- Ghanas ananasbønder har brug for mere intensiv træning
- Multi-etniske kvarterer i England bevarer mangfoldighed i modsætning til i U.S.A.
- Smeltende is lige afsløret et gammelt ulvehoved - og det er et dårligt tegn for os
- Forskere gør kritiske fremskridt med at kvantificere metan frigivet fra Ishavet
- Hvorfor lever aber i regnskoven?
- Hvilke arter af planter lever i akvatisk biom?


