Et lovende mål for nye RNA-terapier nu tilgængelig
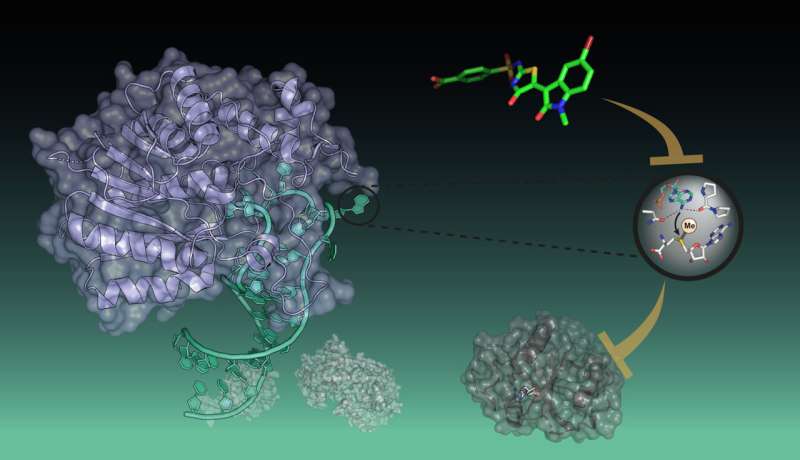
Først for nylig begyndte en ny æra inden for medicin med de første RNA-vacciner. Disse aktive stoffer er modificerede RNA'er, der udløser immunreaktioner fra det menneskelige immunsystem. En anden tilgang inden for RNA-medicin retter sig mod kroppens eget RNA og dets proteinmodulatorer ved hjælp af specifikt skræddersyede aktive stoffer.
Forskere omkring Peng Wu, forskningsgruppeleder ved Chemical Genomics Center ved Max Planck Institute of Molecular Physiology i Dortmund, har nu udviklet de første små molekyle-hæmmere mod det RNA-modificerende enzym METTL16. Methyltransferasen er ansvarlig for reguleringen af forskellige RNA'er og er et lovende anti-cancer-mål.
De nye resultater danner grundlaget for en omfattende undersøgelse af METTL16's rolle i sundhed og sygdom og er et skridt nærmere udviklingen af terapeutiske midler rettet mod sådanne RNA-modifikatorer. Forskningen er publiceret i tidsskriftet JACS Au .
RNA har længe kun været betragtet som en passiv budbringer i cellen, produceret ved DNA-transskription for at overføre genetisk information til proteinfabrikkerne, ribosomerne. Det har dog vist sig, at RNA gør meget mere end det. Ud over det netop beskrevne kodende DNA er der også ikke-kodende DNA, der kontrollerer mange cellulære processer ved at regulere genernes aktivitet på mange niveauer. Ikke mindre end et dusin RNA-klasser er blevet identificeret. RNAi bruges f.eks. af cellen til at nedbryde bestemte RNA-mål for at dæmpe gener, når det kommer til at bekæmpe fremmed viralt DNA.
Læsere, skribenter og viskelædere
RNA interagerer med et væld af biomolekyler, ikke kun andre RNA'er eller DNA, men også proteiner og metabolitter. De resulterende regulatoriske komplekser styrer forskellige vitale cellulære processer, og fejl kan forårsage sygdomme. RNA's skæbne bestemmes af kemiske modifikationer, der påvirker dets stabilitet, struktur og interaktioner og dermed dets skæbne.
Mere end 170 forskellige RNA-modifikationer er blevet beskrevet indtil videre. Den mest udbredte er methyleringen på N6-positionen af RNA-nukleotid adenosin (m6A). Det giver cellen mulighed for hurtigt at reagere på miljøændringer ved at igangsætte passende cellulære reaktioner, såsom deling, differentiering eller migration.
Dette er grunden til, at RNA-methylering skal kontrolleres nøje, varetages af et sæt proteiner:"skrivere" afsætter, "læsere" genkender og "viskere" fjerner methylgruppen.
Nyt stof forhindrer skrivning til RNA
Aberrant RNA-methylering er blevet forbundet med cancer og andre menneskelige sygdomme, hvilket gør "skribenter" til et attraktivt terapeutisk mål. Kun en håndfuld RNA m6A-skrivere er blevet identificeret indtil videre. Og kun for én af dem, METTL3, er potente hæmmere blevet rapporteret. Disse molekyler forhindrer forfatteren i at absorbere blækket, biomolekylet S-adenosylmethionin (SAM).
Gruppen af Peng Wu har nu identificeret den første inhibitor af forfatteren METTL16. I modsætning til de førnævnte hæmmere viste den imidlertid en anden virkemåde:den forhindrer interaktionen af METTL16 med RNA. Forskerne var i stand til at identificere denne nye type inhibitor ved at udvikle et assay, der evaluerede forstyrrelsen mellem METTL16 og et fluorofor-mærket mRNA-substrat.
"Visse kræftceller har forhøjede writer-niveauer og er også mere sårbare over for reduktion af SAM-niveauer, hvilket gør dem til lovende anticancer-mål. De nøjagtige biologiske konsekvenser af METTL16's binding til RNA-substrater er dog endnu ikke klart fastlagt. Med vores arbejde ligger vi fast. grundlaget for en bedre undersøgelse af METTL16's rolle i sygdom og sundhed, men også for udviklingen af nye RNA-målrettede terapier," siger Peng Wu.
Flere oplysninger: Yang Liu et al, Aminothiazolon-hæmmere forstyrrer protein-RNA-interaktionen af METTL16 og modulerer m6A RNA-modifikationen, JACS Au (2024). DOI:10.1021/jacsau.3c00832
Leveret af Max Planck Society
 Varme artikler
Varme artikler
-
 Simpel ligning styrer skabelsen af ren-energi katalysatorerTilpasset fra figur i Nature Catalysis / Springer Nature. Kredit:University of Nebraska-Lincoln Nye retningslinjer fastsat af Nebraska og kinesiske forskere kunne styre designet af billigere, mere
Simpel ligning styrer skabelsen af ren-energi katalysatorerTilpasset fra figur i Nature Catalysis / Springer Nature. Kredit:University of Nebraska-Lincoln Nye retningslinjer fastsat af Nebraska og kinesiske forskere kunne styre designet af billigere, mere -
 Vibration kun i én retningDet nydesignede materiale. Den transmitterer vibrationer fra venstre mod højre, men ikke fra højre mod venstre. Kredit:UvA/Brandenbourger et al. Elektroniske komponenter såsom transistorer transmi
Vibration kun i én retningDet nydesignede materiale. Den transmitterer vibrationer fra venstre mod højre, men ikke fra højre mod venstre. Kredit:UvA/Brandenbourger et al. Elektroniske komponenter såsom transistorer transmi -
 Højtydende enkeltatomkatalysatorer til høj temperatur brændselscellerKonceptuelt diagram over enkeltatomskatalysator udviklet af KIST -forskere. Kredit:Korea Institue of Science and Technology (KIST) I modsætning til sekundære batterier, der skal genoplades, brænds
Højtydende enkeltatomkatalysatorer til høj temperatur brændselscellerKonceptuelt diagram over enkeltatomskatalysator udviklet af KIST -forskere. Kredit:Korea Institue of Science and Technology (KIST) I modsætning til sekundære batterier, der skal genoplades, brænds -
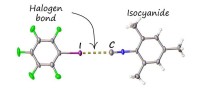 Ny ikke -kovalent binding blokerer frastødende lugt af isocyaniderStrukturen af associerede iodopentafluorobensen med mesityl isocyanid, etableret ved røntgendiffraktion ved Research Park ved St. Petersburg State University. Kredit:SPbU Isocyanider er en vigti
Ny ikke -kovalent binding blokerer frastødende lugt af isocyaniderStrukturen af associerede iodopentafluorobensen med mesityl isocyanid, etableret ved røntgendiffraktion ved Research Park ved St. Petersburg State University. Kredit:SPbU Isocyanider er en vigti
- Er traditionel heteroseksuel romantik sexistisk?
- Hvordan klimaændringer stresser planter og ændrer deres vækst
- Den første Copernicus-satellit overstiger designets levetid
- At leve med kunstig intelligens - hvordan får vi det rigtigt?
- Halvtreds simuleringer af 'Really Big One' viser, hvordan et 9.0 Cascadia-jordskælv kunne udspille …
- Hvordan beregner jeg procentdelen af et mål?


