Hurtig foldning til syntetiske peptider og mikroproteiner
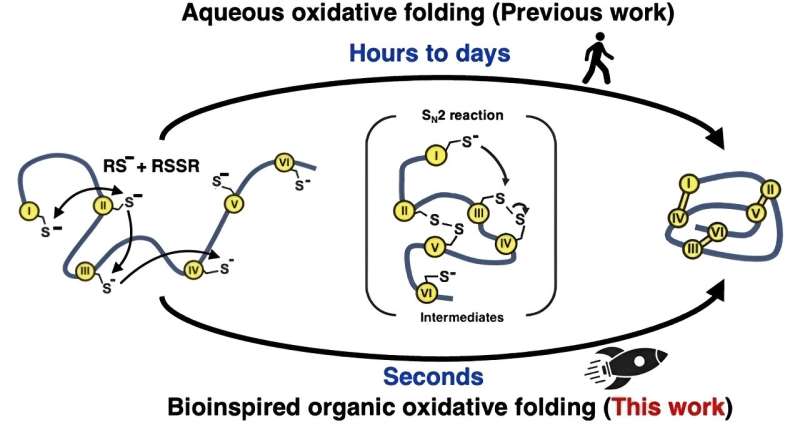
Visse typer peptider og mikroproteiner til forskning i lægemiddelopdagelse kan fremstilles mere effektivt og hurtigt ved hjælp af et reaktionsopløsningsmiddel, der hjælper med at efterligne naturens måde.
Kemikere kan nu producere en vigtig klasse af små proteiner kaldet cysteinrige peptider i deres naturligt foldede 3D-struktur mere pålideligt og meget hurtigere takket være metoder, der efterligner, hvad der sker inde i celler. Fremskridtet, opnået af forskere ved Xi'an Jiaotong-Liverpool University (XJTLU) i Kina og Nanyang Technological University (NTU) i Singapore, er offentliggjort i tidsskriftet Angewandte Chemie .
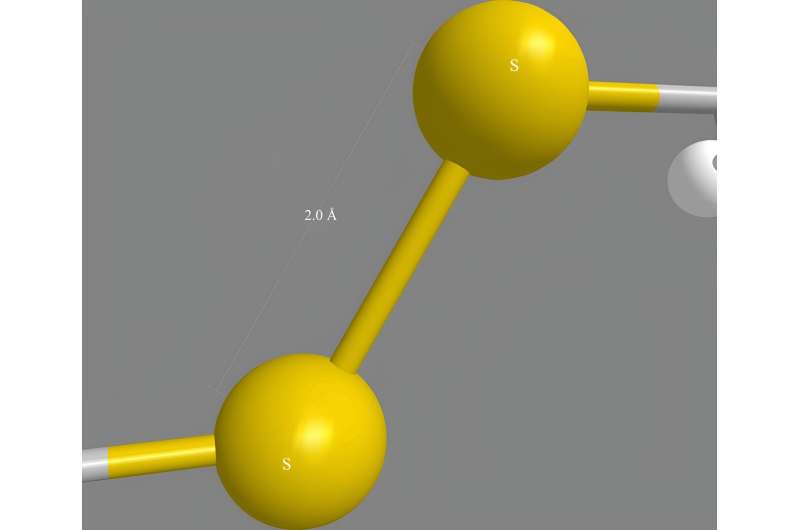
Cystein er et af de mange forskellige aminosyremolekyler, der kan bindes sammen og danne proteinkæder. Peptider er kæder, der er kortere end mange naturlige proteiner. Cysteinmolekyler indeholder hver et svovlatom, der kan blive bundet til svovl fra et andet cystein et andet sted i et protein og holde forskellige dele af kæden sammen.
"Genskabelse af 3D-formerne af cysteinrige peptider har altid været et stort problem i deres fremstilling," siger Dr. Shining Loo fra XJTLU-teamet. Mange bioaktive proteiner og peptider har flere disulfidbindinger mellem cysteinaminosyrer, som er afgørende for at opretholde deres præcise 3D-foldede struktur. Lægemidler som linaclotide mod forstoppelse og ziconotid mod kroniske smerter er eksempler på cysteinrige peptidlægemidler på markedet.
"Vores procedure bør åbne op for nye muligheder for opdagelse af lægemidler og omkostningseffektiv fremstilling af cysteinrige mikroproteiner og peptider som terapeutiske midler," tilføjer forsker Dr. Antony Kam fra XJTLU-teamet.
Naturens indflydelse
Inspireret af, hvordan naturen hurtigt folder proteiner inde i celler, forsøgte forskerne en anden tilgang til de 'oxidative' foldningsreaktioner, der danner disulfidbindingerne. I stedet for at bruge vandbaserede (vandige) opløsninger brugte de en blanding af organiske opløsningsmidler. Denne metode imiterer det naturlige enzym, der medierer disulfidbindingsdannelsen, ved at skabe et meget reaktivt miljø for i høj grad at fremskynde dannelsen og omarrangeringen af disse bindinger.
Ved at lære af naturen på denne måde var holdet i stand til at fremstille 15 forskellige peptider og mikroproteiner, mellem 14 og 58 aminosyrer lange med to til fem disulfidbindinger, med hastigheder mere end 100.000 gange hurtigere end det kunne opnås i vandige opløsningsmidler.
"Foldningen blev effektivt fuldført inden for et sekund," bemærker Dr. Loo, "Og rækken af mikroproteiner, vi producerede, viser, at vores metode burde være effektiv med et meget større udvalg af peptider og mikroproteiner i fremtidige undersøgelser."
Denne opdagelse er det seneste fremskridt fra XPad (XJTLU Peptide and Drug) forskningsgruppen, som er etableret i fællesskab af Dr. Loo og Dr. Kam. Denne gruppe er forpligtet til at bruge værktøjer fra kemisk biologi, syntetisk biologi og molekylær farmakologi til at fremme anvendelsen af peptider til udvikling af terapeutiske midler.
"Fremtiden for peptidforskning lover meget, og vi er forpligtet til at levere endnu mere værdifulde fremskridt på dette område," konkluderer Dr. Kam.
Flere oplysninger: Antony Kam et al., Ultrafast Biomimetic Oxidative Folding of Cystein-rich Peptides and Microproteins in Organic Solvents, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317789
Journaloplysninger: Angewandte Chemie , Angewandte Chemie International Edition
Leveret af Xi'an jiaotong-Liverpool University
 Varme artikler
Varme artikler
-
 Guldnanopartikler øger lysemissionen fra wolframdisulfidFiguren viser fluorescensmikroskopibilledet af en trekantet WS2-flage. Indsatsen viser det optiske mikroskopibillede af monoflaken. (a) Når ophidset, den trekantede flage gløder og viser et fængslende
Guldnanopartikler øger lysemissionen fra wolframdisulfidFiguren viser fluorescensmikroskopibilledet af en trekantet WS2-flage. Indsatsen viser det optiske mikroskopibillede af monoflaken. (a) Når ophidset, den trekantede flage gløder og viser et fængslende -
 Forskere kaster nyt lys over påvisning af influenzaVirale kulturer er guldstandarden for diagnosticering af influenza, men det tager flere dage at udvikle sig. Ved at målrette et enzym, der er iboende for virussen og identificere dets tilstedeværelse
Forskere kaster nyt lys over påvisning af influenzaVirale kulturer er guldstandarden for diagnosticering af influenza, men det tager flere dage at udvikle sig. Ved at målrette et enzym, der er iboende for virussen og identificere dets tilstedeværelse -
 Absorberet pasform til acetylenKredit:Wiley Vi siger ofte, at et substrat passer ind i sit enzym som en nøgle i en lås, men denne metafor er ufuldkommen. Substratbinding kan også ændre låsen (enzymets struktur) for at fremkalde
Absorberet pasform til acetylenKredit:Wiley Vi siger ofte, at et substrat passer ind i sit enzym som en nøgle i en lås, men denne metafor er ufuldkommen. Substratbinding kan også ændre låsen (enzymets struktur) for at fremkalde -
 Livslignende celler kan nu kommunikere over lange afstande via signalforstærkningSkematisk over kommunikationen mellem to populationer af kunstige celler. Kredit:Bastiaan Buddingh Forskere har store drømme for kunstige celler. Disse replikaer af biologiske celler i laboratorie
Livslignende celler kan nu kommunikere over lange afstande via signalforstærkningSkematisk over kommunikationen mellem to populationer af kunstige celler. Kredit:Bastiaan Buddingh Forskere har store drømme for kunstige celler. Disse replikaer af biologiske celler i laboratorie
- Gør en almindelig plast til molekyler af høj værdi
- Sådan kalibrerer du et infrarødt spektrofotometer
- Mød open source-softwaren, der driver NASAs Ingenuity Mars Helicopter
- Hvordan mosser og klima former kvælstofs skæbne i boreal
- Hollænder ruller orange tæppe ud for at besøge forretninger efter Brexit
- Tunesiens banebrydende inden for middelhavstangopdræt


