En enkel og robust metode til at tilføje funktionelle molekyler til peptider
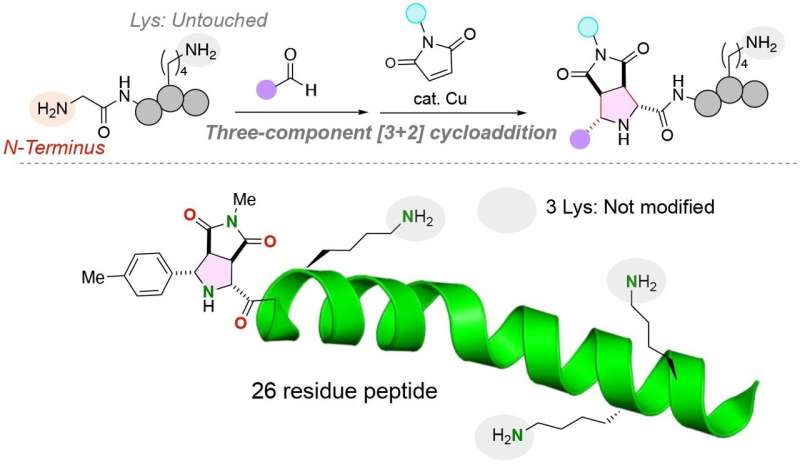
Peptider er korte strenge af aminosyrer, der i stigende grad anvendes terapeutisk, som biomaterialer og som kemiske og biologiske prober. Kapaciteten til at isolere, manipulere og mærke peptider og større proteiner er imidlertid begrænset af evnen til pålideligt at binde funktionelle molekyler, såsom fluorescerende forbindelser, til peptider på steder, der ikke vil påvirke den tredimensionelle struktur og funktion af den korte aminosyrestreng.
Forskere er mest interesserede i at tilføje funktionelle molekyler til N-terminalen eller enden af et peptid med en fri amingruppe (NH2 ), af en aminosyrestreng for at minimere interferensen af funktionelle molekyler med strukturen og funktionen af det bundne peptid.
Tidligere metoder til at binde funktionelle molekyler til N-terminalen af peptider var utilstrækkelige af flere årsager:(1) de funktionelle grupper ville frigives fra peptidet under humane fysiologiske forhold, (2) kun én funktionel gruppe kunne bindes til et peptid ved en tid, (3) binding af funktionelle molekyler til peptider var ikke ensartet, eller (4) reaktioner var simpelthen ikke effektive.
For at løse dette problem udviklede forskere fra Tohoku University og Chuo University en unik kemisk reaktion til at knytte to forskellige funktionelle molekyler til N-terminalen af et peptid med en glycinaminosyre ved N-terminalen. Forskerne offentliggjorde deres undersøgelse i udgaven af 28. januar 2024 af tidsskriftet Angewandte Chemie International Edition .
"Udfordringen [ved at modificere peptidstrukturer] ligger i at opnå stedselektiv modifikation, især i nærvær af meget reaktive lysinrester. Vores tilgang er bemærkelsesværdig for dens evne til udelukkende at funktionalisere N-terminalen af peptider, uanset lysinrester, hvilket resulterer i i strukturelt ensartede konjugater i høje udbytter.
"Desuden letter trekomponentprotokollen den samtidige installation af to funktionelle molekyler i et peptid," sagde Kazuya Kanemoto, seniorforfatter af papiret og assisterende professor ved Graduate School of Pharmaceutical Sciences ved Tohoku University i Japan.
Holdet har med succes knyttet de to distinkte funktionelle molekyler til glycinaminosyren ved at bruge en kobberkatalysator i en tre-komponent reaktion af peptider, aldehyder (enhver organisk forbindelse med et kulstofatom, der deler en dobbeltbinding med et oxygenatom, en enkeltbinding med et brintatom og en enkeltbinding med et andet atom) og maleimider, molekyler, der er vigtige byggesten i organiske syntesereaktioner.
Bemærkelsesværdigt nok udføres reaktionen i en enkelt gryde under milde forhold, hvilket resulterer i en meget effektiv reaktion med stabile carbon-carbonbindinger mellem peptidets N-terminale ende og de funktionelle molekyler.
Især lysinaminosyrer har kompliceret tilføjelsen af funktionelle molekyler til N-terminalen af peptider. Den funktionelle gruppe af lysinaminosyrer er en amingruppe, der potentielt kunne konkurrere med den amingruppe, der er til stede ved N-terminalen af en peptidstreng. Det er vigtigt, at den kemiske reaktion udviklet af forskerholdet kun mærker den N-terminale anime-gruppe af peptider, selvom en lysinaminosyre, der indeholder en alternativ amingruppe, er til stede i peptidet.
Forskerholdet fandt ud af, at den N-terminale binding af funktionelle grupper til peptider kunne optimeres til en række forskellige di-, tri- og oligopeptider, hvilket demonstrerer reaktionens potentielle nytte ved mærkning af forskellige peptider og potentielt større proteiner til oprensning, påvisning og andre formål. .
Forskerne er allerede ved at teste funktionen af peptider, der er blevet modificeret gennem deres nye reaktion for at bestemme egnetheden af det endelige produkt til forskellige forsknings- og terapeutiske formål.
"Vores efterfølgende trin involverer evaluering af den biologiske aktivitet af peptider fremstillet ved denne reaktion. Derudover sigter vi mod at udvide anvendelsen af denne stedselektive dobbeltmodifikationsprotokol til større peptider såsom proteiner og antistoffer, hvilket viser løfte om fremskridt inden for lægemiddellevering." sagde Kanemoto.
Flere oplysninger: Haruka Machida et al, N-Terminal-Specific Dual Modification of Peptides through Copper-Catalyzed [3+2] Cyclloaddition, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202320012
Leveret af Tohoku University
 Varme artikler
Varme artikler
-
 Forskere bruger nye teknologier for at se vand som aldrig førKredit:Pxhere Fra skabelsen af en enkelt dråbe til strømmen af en flod og verdens hydrologiske kredsløb – hvordan vand binder sammen, og til forskellige overflader, har vidtrækkende konsekvens
Forskere bruger nye teknologier for at se vand som aldrig førKredit:Pxhere Fra skabelsen af en enkelt dråbe til strømmen af en flod og verdens hydrologiske kredsløb – hvordan vand binder sammen, og til forskellige overflader, har vidtrækkende konsekvens -
 Hvordan nye materialer øger effektiviteten af direkte ethanolbrændselscellerMaterialet består af Nafion med indlejrede nanopartikler. Kredit:B.Matos/IPEN Ethanol har fem gange højere volumetrisk energitæthed (6,7 kWh/L) end brint (1,3 kWh/L) og kan sikkert bruges i brænds
Hvordan nye materialer øger effektiviteten af direkte ethanolbrændselscellerMaterialet består af Nafion med indlejrede nanopartikler. Kredit:B.Matos/IPEN Ethanol har fem gange højere volumetrisk energitæthed (6,7 kWh/L) end brint (1,3 kWh/L) og kan sikkert bruges i brænds -
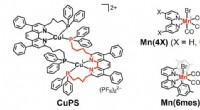 Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo
Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo -
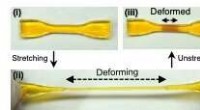 Selvvoksende materialer, der styrker som reaktion på kraftEn dobbeltnetværkshydrogel (i). Efter strækning (ii), skøre sektioner går i stykker, tillader en generation af mekanoradikale stoffer, angivet ved farveændring (iii). Kredit:Gong J.P. et al., Mekanore
Selvvoksende materialer, der styrker som reaktion på kraftEn dobbeltnetværkshydrogel (i). Efter strækning (ii), skøre sektioner går i stykker, tillader en generation af mekanoradikale stoffer, angivet ved farveændring (iii). Kredit:Gong J.P. et al., Mekanore
- Sådan beregnes din vægt på månen
- Forskere er verdens første til at reproducere en komplet kopi af anti-tumor-antibiotikum
- Ny undersøgelse validerer metode til guidet opdagelse af 3D fladbåndsmaterialer
- NASA/JAXA-satellitten finder kraftig nedbør i den tropiske storm Isaac
- at reducere omkostningerne til ethanol, andre biobrændstoffer og benzin
- Universiteter aflyser studier i udlandet på grund af virusfrygt


