Første molekylære indsigt i nedbrydningen af den ribosomale 30S-underenhed
Et forskerhold fra Institut for Kemi ved Universität Hamburg er for første gang lykkedes med på molekylært niveau at identificere den dynamiske mekanisme, som enzymet RNase R bruger til at nedbryde den ribosomale 30S-underenhed. Resultaterne af undersøgelsen blev offentliggjort i det videnskabelige tidsskrift Nature .
Proteinsyntese er en vital og energikrævende proces i cellen, hvor ribosomer spiller en afgørende rolle. Disse forholdsvis store molekyler findes i alle levende organismer og fungerer som cellens "proteinfabrikker."
For at gøre dette læser ribosomer planen for et specifikt protein på et messenger-molekyle - messenger-RNA'et (mRNA) - og konverterer derefter denne information til et nyt protein. Ribosomer består af to underenheder. Den lille underenhed er ansvarlig for at læse og kontrollere mRNA'et for fejl, mens den store underenhed er ansvarlig for polymeriseringen af aminosyrer til dannelse af proteiner.
Kontrolleret produktion og reguleret omsætning af ribosomer er påkrævet for proteinsyntese. Mens samlingen af ribosomer er blevet stadig bedre forstået i de senere år, har der ikke været nogen strukturel indsigt i nedbrydningen af ribosomer.
Dette er vigtigt, fordi celler i stresssituationer som mangel på mad eller i slutningen af deres vækstcyklus reducerer deres stofskifte for at overleve længere. Denne tilstand er kendt som den stationære fase. I denne fase reduceres energiintensiv proteinsyntese, og nogle ribosomer nedbrydes for at frigive den energi, der investeres i dem for at sikre celleoverlevelse.
Til deres undersøgelser har forskerne studeret Bacillus subtilis, en stavformet jordbakterie, der findes i luft, støv og vand samt i tarmene hos mennesker og dyr. "I modsætning til tidligere undersøgelser tog vi celler, der stadig voksede og ikke var i den stationære fase. Vi ville gerne vide, hvilke processer der finder sted ved overgangen til den stationære fase," siger læge Helge Paternoga fra Kemisk Institut på Universität Hamburg, sidste forfatter til undersøgelsen.
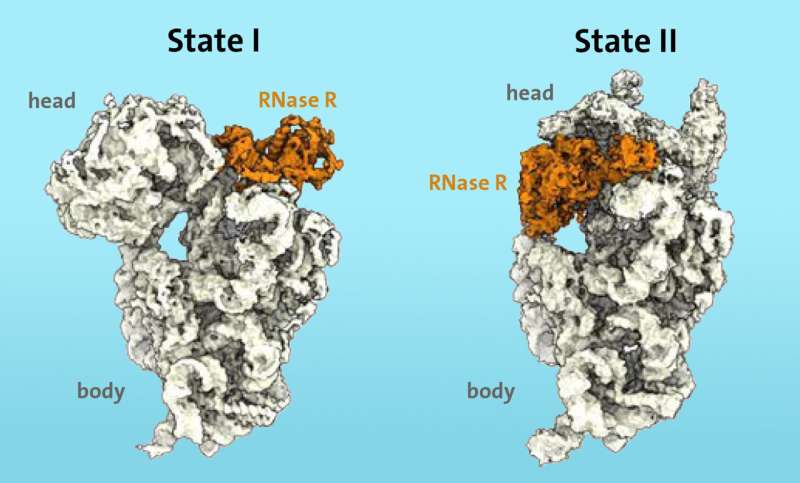
Forskerne vidste fra tidligere arbejde, at visse enzymer, såsom ribonuclease R (RNase R), er involveret i nedbrydningsprocessen af ribosomer i stresssituationer. Ved hjælp af kryo-elektronmikroskopi kunne de for første gang vise, at enzymet RNase R binder sig til den lille 30S-underenhed af ribosomet. "S" står for "Svedberg-enheder" og henviser til massen af den ribosomale underenhed.
RNase R skærer ikke vilkårligt 30S-underenheden, men knytter sig snarere til et frit område, som forskerne kalder "halsen", og løsner derefter "hovedet", det øverste område af underenheden, i to på hinanden følgende trin.
"I første trin støder enzymet RNase R på en forhindring ved 'halsen' og destabiliserer nakkeområdet, hvilket gør det mere fleksibelt. I det andet trin drejes 'hovedet', hvilket fjerner forhindringen og gør det muligt for enzymet at fortsæt uhindret nedbrydningsprocessen af 30S-underenheden," forklarer Paternoga.
"Vores in vitro-nedbrydningseksperimenter indikerer, at 'hoved'-omskifteren er en væsentlig kinetisk barriere for RNase R. Desuden var vi i stand til at vise, at enzymet alene er tilstrækkeligt til at gennemføre den komplette 30S-nedbrydningsproces" siger prof. Dr. Daniel Wilson, leder af forskningsgruppen ved Institut for Kemi ved Universität Hamburg og medforfatter til undersøgelsen.
Flere oplysninger: Lyudmila Dimitrova-Paternoga et al., Strukturelt grundlag for ribosomal 30S-underenhedsnedbrydning af RNase R, Nature (2024). DOI:10.1038/s41586-024-07027-6
Leveret af University of Hamburg
Sidste artikelEn ny teknik til at skabe superhydrofobe overflader
Næste artikelDrivhusgas genbrugt i nye eksperimenter
 Varme artikler
Varme artikler
-
 Udvikling af kemiske reaktioner med fjernbetjeningToppanel:Et kort lysudbrud interagerer med et rum, der indeholder en katalysator (vist i blåt). Bundpanel:Kort tid senere, en lignende buste af lys interagerer med en anden beholder, der indeholder re
Udvikling af kemiske reaktioner med fjernbetjeningToppanel:Et kort lysudbrud interagerer med et rum, der indeholder en katalysator (vist i blåt). Bundpanel:Kort tid senere, en lignende buste af lys interagerer med en anden beholder, der indeholder re -
 Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite
Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite -
 Optagelse af 3-D mikrostrukturer i realtidMaskinlæring aktiveret karakterisering af 3D-mikrostruktur, der viser korn af forskellige størrelser og deres grænser. Kredit:Argonne National Laboratory Moderne videnskabelig forskning i material
Optagelse af 3-D mikrostrukturer i realtidMaskinlæring aktiveret karakterisering af 3D-mikrostruktur, der viser korn af forskellige størrelser og deres grænser. Kredit:Argonne National Laboratory Moderne videnskabelig forskning i material -
 Biominering af fremtidens elementerKredit:Joey Kyber/Pixels, CC BY-SA Biomining er den slags teknik, der loves af science fiction:en stor tank fyldt med mikroorganismer, der udvasker metal fra malm, gamle mobiltelefoner og harddisk
Biominering af fremtidens elementerKredit:Joey Kyber/Pixels, CC BY-SA Biomining er den slags teknik, der loves af science fiction:en stor tank fyldt med mikroorganismer, der udvasker metal fra malm, gamle mobiltelefoner og harddisk
- Ligner en komet, men føler en asteroide? Det er vildt!
- Lavtemperaturfysik giver indsigt i turbulens
- Ikke-giftigt materiale viste sig at være en ultra-stærk solenergihøster
- Handelsregler dukker op som et våben til at bekæmpe klimaændringer i Europa
- Hvad er landbrugs bioteknologi?
- Blærende stjerner i universet:Sjælden indsigt i stjernernes udvikling


