Molekylær simulering AI-værktøj afslører uløst struktur af transportørprotein
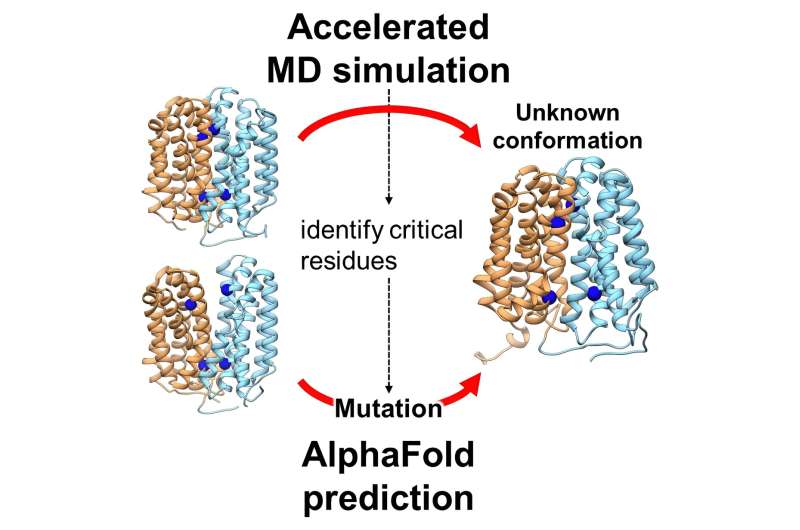
I et banebrydende studie har forskere afsløret en hidtil ukendt konformationstilstand af et afgørende transportprotein, OxlT, som spiller en afgørende rolle i at forhindre dannelse af nyresten. Denne opdagelse, opnået gennem avancerede beregningsmetoder, giver ny indsigt i proteinfunktion og potentielle terapeutiske mål.
Proteiner er livets byggesten og udfører essentielle funktioner i enhver levende organisme. Transporterproteiner, som OxlT, er særligt vigtige, da de transporterer vitale stoffer over cellemembraner. OxlT, der findes i den oxalat-nedbrydende bakterie Oxalobacter formigenes, er medvirkende til at styre oxalatniveauerne i den menneskelige krop.
Overskydende oxalat kan føre til nyresten, et smertefuldt og udbredt sundhedsproblem. At forstå OxlT's funktion er afgørende, men indtil nu har videnskabsmænd manglet omfattende viden om dets forskellige strukturelle tilstande, især den indad-åbne konformation, en kritisk del af dens transportmekanisme.
Denne undersøgelse, ledet af Jun Ohnuki og hans kolleger, brugte avancerede beregningsteknikker til at simulere OxlT-proteinets dynamik. De brugte Gaussisk accelereret molekylær dynamik (GaMD) og AlphaFold2, et banebrydende maskinlæringsværktøj, til at udforske OxlTs struktur og funktion. Artiklen, "Accelerated Molecular Dynamics and AlphaFold Uncover a Missing Conformational State of Transporter Protein OxlT," er offentliggjort i The Journal of Physical Chemistry Letters .
Holdet forudsagde med succes den uhåndgribelige indad-åbne konformation af OxlT, et vigtigt skridt i forståelsen af dets komplette funktionelle cyklus. Denne konformation afslørede, at OxlT foretrækker binding til formiat frem for oxalat i denne tilstand, et afgørende aspekt af dets rolle i oxalathåndtering.
Desuden identificerede forskningen specifikke aminosyrerester, der var afgørende for denne konformationelle overgang, et fund, der kunne have bredere implikationer for forståelsen af proteindynamik.
Implikationerne af denne forskning strækker sig ud over et enkelt protein. Metoden og indsigten opnået fra denne undersøgelse giver en skabelon til at udforske andre proteiners dynamik, især transporterproteiner, som ofte er mål for terapeutiske lægemidler.
Forståelse af disse proteiner på et detaljeret niveau kan føre til udvikling af mere effektive behandlinger til en række forskellige tilstande. Derudover eksemplificerer denne forskning styrken ved at kombinere beregningsbiologi med maskinlæring, et felt i hastig udvikling, der lover at låse op for mange af biologiens mest udfordrende mysterier.
Ved at udfylde et afgørende hul i vores forståelse af OxlT-proteinet bidrager denne undersøgelse ikke kun til potentielle fremskridt inden for forebyggelse af nyresten, men baner også vejen for fremtidige gennembrud inden for biomedicinsk forskning.
Forskerholdet omfatter Jun Ohnuki, Titouan Jaunet-Lahary og Kei-ichi Okazaki fra Research Center for Computational Science ved Institute for Molecular Science (IMS), NINS. Atsuko Yamashita fra Graduate School of Medicine, Dentistry and Pharmaceutical Sciences ved Okayama University fuldender holdet.
Flere oplysninger: Jun Ohnuki et al., Accelerated Molecular Dynamics and AlphaFold afslører en manglende konformationstilstand for transporterprotein OxlT, The Journal of Physical Chemistry Letters (2024). DOI:10.1021/acs.jpclett.3c03052
Journaloplysninger: Journal of Physical Chemistry Letters
Leveret af National Institutes of Natural Sciences
 Varme artikler
Varme artikler
-
 Hvordan patogene bakterier forbereder et klæbrigt adhæsionsproteinPatogene gram-positive bakterier, såsom S. gordonii , eksportere et serinrigt adhæsin for at lette deres binding til værtsceller. Adhesin bruger en dedikeret sekretionsvej, med flere trin, der forek
Hvordan patogene bakterier forbereder et klæbrigt adhæsionsproteinPatogene gram-positive bakterier, såsom S. gordonii , eksportere et serinrigt adhæsin for at lette deres binding til værtsceller. Adhesin bruger en dedikeret sekretionsvej, med flere trin, der forek -
 Undersøgelse afslører dynamisk adfærd af Cu-N-C enkeltatom-katalysator i elektrokatalyseKredit:CC0 Public Domain Atomisk dispergerede M-N-C (M refererer til overgangsmetaller) materialer betragtes som de mest lovende alternativer til de Pt-baserede ædelmetalkatalysatorer til elektrok
Undersøgelse afslører dynamisk adfærd af Cu-N-C enkeltatom-katalysator i elektrokatalyseKredit:CC0 Public Domain Atomisk dispergerede M-N-C (M refererer til overgangsmetaller) materialer betragtes som de mest lovende alternativer til de Pt-baserede ædelmetalkatalysatorer til elektrok -
 Ozon nedbryder THC aflejret på overflader fra tredjehånds cannabisrøgKredit:CC0 Public Domain Anden og tredjehånds tobaksrøg har fået masser af opmærksomhed, men meget mindre er kendt om de forbindelser, der aflejres på overflader fra cannabisrøg. Nu, forskere, der
Ozon nedbryder THC aflejret på overflader fra tredjehånds cannabisrøgKredit:CC0 Public Domain Anden og tredjehånds tobaksrøg har fået masser af opmærksomhed, men meget mindre er kendt om de forbindelser, der aflejres på overflader fra cannabisrøg. Nu, forskere, der -
 Ny katalysator forvandler forurenende stoffer til brændstofHaotian Wang, hvem vil slutte sig til Rice fakultetet senere i år, er hovedforfatter til en undersøgelse, der skal omdanne kuldioxid til kulilte og andre industrielle brændstoffer. Kredit:Jon Chase/Ha
Ny katalysator forvandler forurenende stoffer til brændstofHaotian Wang, hvem vil slutte sig til Rice fakultetet senere i år, er hovedforfatter til en undersøgelse, der skal omdanne kuldioxid til kulilte og andre industrielle brændstoffer. Kredit:Jon Chase/Ha
- Hvilke typer bakterier er parasitter?
- 10 præstationsfremmende lægemidler, der ikke er steroider
- Kulboble kommer, der kan slette billioner fra den globale økonomi:undersøgelse
- Kraftig jordskælv rammer grænsen mellem Iran og Irak, 13 døde
- Aerosoldannelse i skyer:At studere klimamodelleringer varer stor usikkerhedsfaktor
- En leviteret nanosfære som en ultrafølsom sensor


