Modificerede koffeinmolekyler hjælper medicinsk forskning med at komme videre
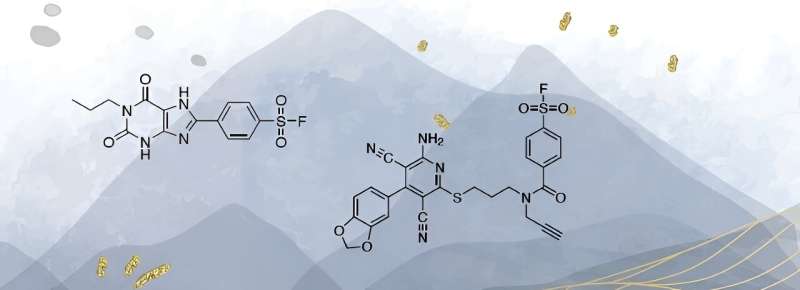
Før forskere kan udvikle målrettede lægemidler, skal de vide præcis, hvordan en sygdom virker. Biokemiker Bert Beerkens skabte molekyler, der giver dem mulighed for at finde ud af det. Han brugte koffein som grundlag for nye molekyler, der muliggør forskning i bestemte receptorproteiner på celler.
Som kemistuderende blev Bert Beerkens fascineret af det forskningsfelt, der gør det muligt at bruge kemi til at studere alle mulige processer i kroppen. "Så designer og producerer man molekyler, der ikke har nogen medicinsk effekt, men som hjælper andre forskere i deres arbejde med en bestemt tilstand."
I sin ph.d. forskning gik Beerkens i gang med at lave molekyler, der binder sig til et protein, der normalt binder stoffet adenosin. Adenosin er overalt i vores krop. Det er en del af DNA og også af ATP:adenosintrifosfat. Dette lagrer energi i alle levende celler og gør det tilgængeligt, hvor det er nødvendigt.
Beerkens siger:"Adenosin er også et signalstof til kommunikation mellem celler. Hvis der er meget adenosin omkring en celle, kan det betyde, at en celle i området er død." Så strejfer adenosin rundt fra nedbrudt ATP, og en nabocelle opfanger det med specielle receptorer på cellemembranen. "Afhængigt af den type celle, der opfanger adenosinen, kan resultatet være, at immunresponset hæmmes. Nogle tumorer misbruger denne mekanisme ved aktivt at producere adenosinreceptorer."
Binder fast til den samt mærkning af receptoren
For at undersøge dette er der brug for molekyler, der ligesom adenosin binder til adenosinreceptorer. Beerkens tog udfordringen op. Koffein blev grundlaget for de stoffer, han udviklede. "Koffein binder sig også til receptoren, bare ikke særlig stærkt."
Beerkens eksperimenterede med yderligere atomgrupper substitueret på koffeinmolekylet. Det lykkedes ham at lave molekyler, der ikke kun binder tæt til receptoren, men også kun til denne type receptor og ikke til noget andet. "Der er fire forskellige adenosinreceptorer. For tre af dem var jeg i stand til at designe passende molekyler. For den fjerde har min forgænger allerede gjort det."
Klikkemi viste sig at være løsningen, ligesom Lego
Molekylerne skulle ikke kun binde tæt og selektivt til receptoren, men også placere et molekylært mærke på den. "Så kan forskere se, om og hvor, hvilken type receptor der er til stede." Den observation skulle også kunne udføres i levende cellemateriale, det vil sige uden høje doser radioaktiv stråling.
Dette var et vanskeligt punkt i Beerkens' projekt. "Vi lykkedes ved at bruge klikkemi." Sidste år gik Nobelprisen i kemi til udviklingen af denne type kemi. "Det fungerer ligesom Lego. Når det koffeinlignende molekyle er knyttet til adenosinreceptoren, klikker et andet molekyle, der for eksempel udsender lys, på det."
Beerkens modtog sin ph.d. i november, hvor hans resultater er blevet offentliggjort tidligere. Er der en umiddelbar hast af forskere, der bruger molekylerne? "For seks måneder siden kom der en henvendelse fra USA. Et hospital ville undersøge en sygdom, hvor adenosin ser ud til at spille en rolle. Udover det sker det stadig primært i og omkring vores laboratorium sammen med LUMC. Det involverer forskning. ind i adenosinreceptorer på visse immunceller for at se, hvad der ville være et godt mål for lægemidler at handle på."
Flere oplysninger: Affinitetsbaseret profilering af adenosinreceptorerne. scholarlypublications.universi … /handle/1887/3656497
Leveret af Leiden University
 Varme artikler
Varme artikler
-
 Lysfarvet 3D-print ved hjælp af flydende krystallera) Oversigt over det centrale element i direkte blækskrivning (DIW):sprøjten med mikrodyse. Angivet er placeringen af blækket, varmekappen (til temperaturstyret DIW), mikrodysen og det trykte objekt
Lysfarvet 3D-print ved hjælp af flydende krystallera) Oversigt over det centrale element i direkte blækskrivning (DIW):sprøjten med mikrodyse. Angivet er placeringen af blækket, varmekappen (til temperaturstyret DIW), mikrodysen og det trykte objekt -
 Video:Skal du tisse på et vandmandsstik?Kredit:The American Chemical Society Jo da, maneter ser temmelig rolige ud, men vi kender alle ondskaberne, der kommer fra et tilløb med de fangarme. Du har sikkert hørt rygtet om, at tisse på et
Video:Skal du tisse på et vandmandsstik?Kredit:The American Chemical Society Jo da, maneter ser temmelig rolige ud, men vi kender alle ondskaberne, der kommer fra et tilløb med de fangarme. Du har sikkert hørt rygtet om, at tisse på et -
 En legering, der bevarer sin hukommelse ved høje temperaturerAlexander Paulsen (th.) og Alberto Ferrari har bragt teori og praksis sammen. Kredit:RUB, Marquard Ved hjælp af computersimulering, Alberto Ferrari beregnede et designforslag til en formhukommelse
En legering, der bevarer sin hukommelse ved høje temperaturerAlexander Paulsen (th.) og Alberto Ferrari har bragt teori og praksis sammen. Kredit:RUB, Marquard Ved hjælp af computersimulering, Alberto Ferrari beregnede et designforslag til en formhukommelse -
 Du smører tro det:Pålæg med lavt kalorieindhold, hovedsagelig lavet af vandDoktorgradskandidat Michelle Lee, forgrunden, og postdoc-forsker Chen Tan arbejder i laboratoriet i Alireza Abbaspourrad for at udvikle et smøragtigt smørepålæg, der hovedsageligt består af vand. Kred
Du smører tro det:Pålæg med lavt kalorieindhold, hovedsagelig lavet af vandDoktorgradskandidat Michelle Lee, forgrunden, og postdoc-forsker Chen Tan arbejder i laboratoriet i Alireza Abbaspourrad for at udvikle et smøragtigt smørepålæg, der hovedsageligt består af vand. Kred
- Elfenbenskystens flydende ø peger på grønnere turisme
- Kometer bidrog til jordens atmosfære, siger undersøgelse af 3 milliarder år gamle mineraler
- Høj varme men ingen rekord:2018 var det 4. varmeste år på Jorden
- Havets temperatur som et vigtigt tegn, der afslører jordens opvarmning
- Sjove eksperimenter til at adskille blandinger
- GTE's rolle i DNA-ekstraktion


