Ny indsigt i antistofaggregation forventes at åbne nye veje for forskning og terapeutiske anvendelser
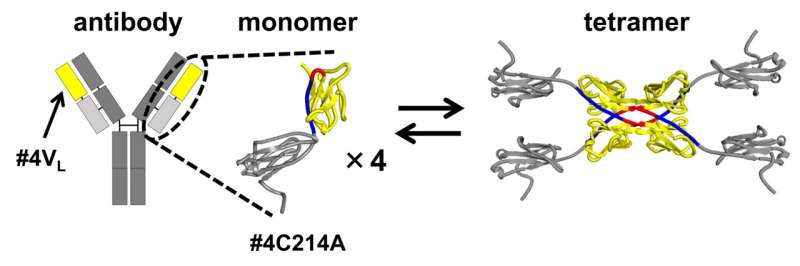
Antistoffer (immunoglobuliner) er Y-formede proteiner, der genkender og neutraliserer specifikke patogener. Deres evne til at målrette mod specifikke molekyler eller celler har gjort dem til lovende kandidater til fremtidig udvikling af lægemidler. Deres lette kæder - dele af antistoffet, der bidrager til at genkende og binde til specifikke antigener - folder sig forkert og aggregerer, hvilket fører til amyloidose, en tilstand, der medfører komplikationer og vævsdysfunktion i kroppen.
I forbindelse med lægemiddeludvikling kan antistofaggregering kompromittere deres evne til at binde til antigener og mindske deres terapeutiske potentiale. Mangel på detaljerede strukturelle oplysninger om dets aggregering er imidlertid en af de faktorer, der hindrer fremskridt på området.
Som et resultat heraf sigter den igangværende indsats på at levere detaljerede rapporter om aggregerede strukturer og deres dannelsesmekanismer for at fremme udviklingen af antistoflægemidler.
I en undersøgelse offentliggjort i Nature Communications , et team af forskere fra Japan, ledet af Shun Hirota fra Nara Institute of Science and Technology (NAIST), har for nylig givet ny indsigt i de strukturer, der dannes under antistofaggregering gennem 3D domænebytning (3D-DS), en proces, hvor en specifik region af et protein udveksles mellem to eller flere molekyler af det samme protein.
3D-DS-processen er blevet observeret i forskellige proteiner, men ikke i antistof-lette kæder indtil denne undersøgelse.
I deres undersøgelse brugte forskerne en modificeret version af antistoffets lette kæde. I denne modificerede form blev en cystein (Cys) rest, som typisk danner en disulfidbinding med en tung kæde cystein, erstattet med alanin (Ala). Denne ændring gjorde det muligt for teamet at isolere og studere de strukturer, der stammer fra 3D-DS i det segment af antistoffet, der bidrager til antigenbinding.
Antistoffets lette kædes 3D-DS involverer dannelsen af dimerer (strukturer bestående af to identiske underenheder) og tetramerer (strukturer sammensat af to dimerer med fire identiske underenheder).
"Vores undersøgelse giver den første rapport om strukturen på atomniveau af 3D-DS-fænomenet i en antistof-letkædes variable region," påpeger Hirota.
Størrelsesudelukkelseskromatografien af antistoffets lette kæde #4C214A afslørede, at antistoffet eksisterer som individuelle monomerer og fire-underenheds-tetramerer. For at bestemme regionen, hvor tetramerer dannes, delte forskerne antistoffets lette kæde i den variable region (spidsen af det Y-formede antistof) og den konstante region (den midterste del af det Y-formede antistof).
De fandt, at den variable region #4VL kan skifte mellem monomere og tetramere tilstande.
Yderligere analyse ved hjælp af røntgenkrystallografi og termodynamiske simuleringer afslørede, at tetramerdannelse er drevet af hydrofobe interaktioner mellem to 3D-DS dimerer.
Sammenlignet med monomerer viste tetramererne sig at have mere stive β-arkstrukturer, hvilket gør dem mindre fleksible. Dannelsen af 3D-DS-tetrameren kan hjælpe med at forhindre proteinaggregering ved at mindske fleksibiliteten og potentielt undgå dannelsen af uopløselige aggregater. På den anden side kan 3D-DS fremme aggregering af antistoffer.
Hirota konkluderer:"Disse resultater tydeliggør ikke kun den domæne-ombyttede struktur af antistoffets lette kæde, men bidrager også til at kontrollere antistofkvaliteten og fremme udviklingen af fremtidige molekylære genkendelsesmidler og lægemidler."
Flere oplysninger: Strukturel og termodynamisk indsigt i antistof-letkæde-tetramerdannelse gennem 3D-domænebytning, naturkommunikation (2023). DOI:10.1038/s41467-023-43443-4
Leveret af Nara Institute of Science and Technology
 Varme artikler
Varme artikler
-
 Forskere simulerer det intracellulære miljø i en selvlysende bakteriecelleEt skema af en bakteriecelle med et fragment af en metabolisk kæde, der fungerer inde i den, omgivet af glycerol eller saccharose, der efterligner det intracellulære miljø. Kredit:Oleg Sutormin. E
Forskere simulerer det intracellulære miljø i en selvlysende bakteriecelleEt skema af en bakteriecelle med et fragment af en metabolisk kæde, der fungerer inde i den, omgivet af glycerol eller saccharose, der efterligner det intracellulære miljø. Kredit:Oleg Sutormin. E -
 Fordelen ved 2D metal-organiske ramme-nanoark i sanseapplikationerGrafisk abstrakt. Kredit:LI Xixuan I de seneste år, fluorescerende metal-organiske rammer (MOFer) er blevet demonstreret som en lovende strategi til konstruktion af sensorer. Imidlertid, de fleste
Fordelen ved 2D metal-organiske ramme-nanoark i sanseapplikationerGrafisk abstrakt. Kredit:LI Xixuan I de seneste år, fluorescerende metal-organiske rammer (MOFer) er blevet demonstreret som en lovende strategi til konstruktion af sensorer. Imidlertid, de fleste -
 Simpel ligning styrer skabelsen af ren-energi katalysatorerTilpasset fra figur i Nature Catalysis / Springer Nature. Kredit:University of Nebraska-Lincoln Nye retningslinjer fastsat af Nebraska og kinesiske forskere kunne styre designet af billigere, mere
Simpel ligning styrer skabelsen af ren-energi katalysatorerTilpasset fra figur i Nature Catalysis / Springer Nature. Kredit:University of Nebraska-Lincoln Nye retningslinjer fastsat af Nebraska og kinesiske forskere kunne styre designet af billigere, mere -
 Fusionsforskere har udviklet en skulpturteknik i nanoskalaSkematisk visning af interaktionen mellem plasma og wolfram (til venstre) og forklaring af nødvendigheden af tyndfilmsprøver og den nanoskala skulpturteknik til TEM-observation (højre). Kredit:NIFS
Fusionsforskere har udviklet en skulpturteknik i nanoskalaSkematisk visning af interaktionen mellem plasma og wolfram (til venstre) og forklaring af nødvendigheden af tyndfilmsprøver og den nanoskala skulpturteknik til TEM-observation (højre). Kredit:NIFS
- Sådan finder du antallet af atomer i et element
- Førsteklasses lektion på Wind
- Rundt om Antarktis:ACE-ekspeditionen gennemførte sin første etape
- Tørke- og barkbiller dræber de ældste træer på Jorden. Kan træerne reddes?
- Arbejdserfaring dårlig forudsigelse af fremtidige jobpræstationer
- Nanorør med to vægge har enestående kvaliteter


