Forskere udnytter flower superpower for at bane vejen for nye lægemiddelbehandlinger
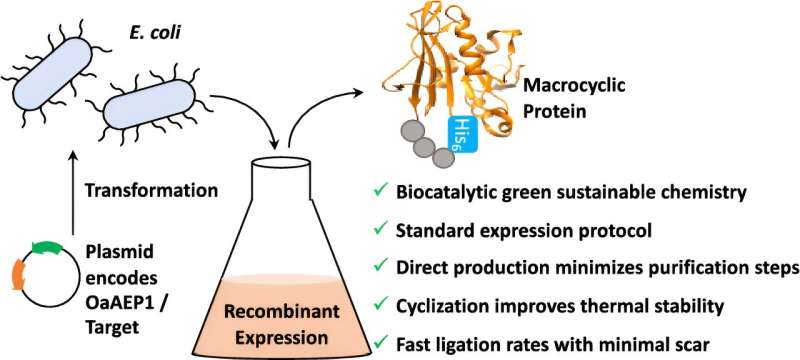
Forskere ved University of Bath har brugt naturen som inspiration til at udvikle et nyt værktøj, der vil hjælpe forskere med at udvikle nye farmaceutiske behandlinger på en renere, grønnere og billigere måde.
Lægemiddelbehandlinger virker ofte ved at binde sig til proteiner involveret i sygdom og blokere deres aktivitet, hvilket enten reducerer symptomer eller behandler sygdommen.
I stedet for at bruge konventionelle små molekyler som lægemidler, der ikke er velegnede til at blokere interaktioner mellem proteiner, undersøger den farmaceutiske industri nu potentialet i at fremstille lægemidler ved hjælp af små proteiner kendt som 'peptider', som virker på lignende måde.
Men peptider og proteiner danner ofte ikke særlig gode lægemidler, fordi deres 3D-strukturer kan optrevle, de er følsomme over for høje temperaturer og kan være svære at få ind i kroppens celler, hvor der findes mange spændende, men udfordrende lægemiddelmål.
Nu har forskere ved University of Bath udviklet en måde at omgå dette problem på; normalt har proteiner og peptidstrenge en start og en ende - ved at forbinde disse løse ender sammen, er det muligt at skabe meget stive "cykliske" proteiner og peptider, som forbedrer varme og kemisk stabilitet samt gør det lettere at få dem ind i cellerne .
De tog et enzym kaldet OaAEP1 fra Oldenlandia affinis, en lille lilla blomst, der vokser i troperne, og modificerede det, før det blev overført til bakterieceller. Disse bakteriekulturer blev dyrket for at masseproducere et protein, samtidig med at enderne blev sammenføjet i et enkelt trin.
Planter kan gøre denne proces naturligt, men den er langsom og giver lavt udbytte. Alternativt kan ringslutning udføres kemisk ved at isolere enzymet og derefter blande flere reagenser i et reagensglas, men dette kræver flere trin og bruger giftige opløsningsmiddelkemikalier.
At sætte hele processen ind i et bakteriesystem øger udbyttet, bruger mere bæredygtige, biologisk venlige reagenser og kræver færre trin. Det er derfor meget enklere og billigere.
For at demonstrere tilgangen anvendte forskerne deres bakterielle OaAEP1-teknologi på et protein kaldet DHFR og fandt ud af, at sammenføjningen af hoved- og halespidserne gjorde det mere modstandsdygtigt over for temperaturændringer, mens det stadig beholdt sin normale funktion.
Professor Jody Mason, fra University of Baths afdeling for biovidenskab, sagde:"Proteiner og peptider er generelt ret følsomme over for varme, men cyklisering gør dem meget mere robuste."
"Oldenlandia-planten fremstiller naturligt cykliske proteiner som en del af en forsvarsmekanisme til at afskrække rovdyr."
"Så vi har udnyttet denne blomstersuperkraft ved at modificere OaAEP1 og kombinere den med eksisterende bakteriel proteinproducerende teknologi for at skabe et virkelig kraftfuldt værktøj, der vil hjælpe lægemiddelindustrien."
Dr. Simon Tang, en forskningsassistent fra University of Baths afdeling for biovidenskab, sagde:"Proteiner og peptider er meget lovende som lægemiddelkandidater, men en betydelig flaskehals for udviklingen af nye terapeutiske behandlinger er at producere nok af tingene til at nå patienter uden at pådrage sig en astronomisk omkostning."
"Vores nye proces lader bakterierne gøre alt arbejdet - resultatet er, at det også er renere og grønnere, og fordi det har færre trin, er det meget nemmere at udføre."
"Vi er virkelig begejstrede for de potentielle anvendelser af dette, ikke kun for den farmaceutiske industri, men andre industrier såsom fødevareindustrien, vaskemiddelindustrien, i bioteknologi og i bioenergiproduktion."
Forskerne har indgivet patent på teknikken og offentliggjort deres arbejde i tidsskriftet JACS Au .
Flere oplysninger: T. M. Simon Tang et al., Intracellulær anvendelse af en asparaginylendopeptidase til fremstilling af rekombinante hoved-til-hale cykliske proteiner, JACS Au (2023). DOI:10.1021/jacsau.3c00591
Leveret af University of Bath
 Varme artikler
Varme artikler
-
 Ny konfiguration af DNA opdagetDNA strækkes mellem to (polystyren) perler (blå), der holdes i laserstråler (rød). Interkalatorer (grønne) gør hyperstrakt DNA synligt. Kredit:Iddo Heller / VU Amsterdam Hvis man trækker tilstrækk
Ny konfiguration af DNA opdagetDNA strækkes mellem to (polystyren) perler (blå), der holdes i laserstråler (rød). Interkalatorer (grønne) gør hyperstrakt DNA synligt. Kredit:Iddo Heller / VU Amsterdam Hvis man trækker tilstrækk -
 Varianter af funktionaliserede aromater ekspanderet ved heteroatom-deltaget lignin-spaltningHeteroatom-holdige reagenser udløser den katalytiske spaltning af ligninbindinger og funktionalisering af produkter samtidigt. Kredit:LI Hongji Lignin er det aromatiske polymerfragment af lignocel
Varianter af funktionaliserede aromater ekspanderet ved heteroatom-deltaget lignin-spaltningHeteroatom-holdige reagenser udløser den katalytiske spaltning af ligninbindinger og funktionalisering af produkter samtidigt. Kredit:LI Hongji Lignin er det aromatiske polymerfragment af lignocel -
 Forskere forbedrer beskrivelsen af defekte oxider med beregning af første principperAt forstå, hvordan defekter kan påvirke grundtilstandsegenskaber, fremme faseovergange, eller muliggøre helt nye funktionaliteter i nogle stærkt korrelerede oxider er blevet et emne af stor interesse
Forskere forbedrer beskrivelsen af defekte oxider med beregning af første principperAt forstå, hvordan defekter kan påvirke grundtilstandsegenskaber, fremme faseovergange, eller muliggøre helt nye funktionaliteter i nogle stærkt korrelerede oxider er blevet et emne af stor interesse -
 Gør dig klar til sommersolen med grønne solcremerKredit:American Chemical Society Selvom det har været en hård vinter for mange mennesker i USA, sommeren kommer. Og det betyder baggårdsgrill, sjov på stranden og selvfølgelig, sladder på solcreme
Gør dig klar til sommersolen med grønne solcremerKredit:American Chemical Society Selvom det har været en hård vinter for mange mennesker i USA, sommeren kommer. Og det betyder baggårdsgrill, sjov på stranden og selvfølgelig, sladder på solcreme
- Det toårige nedbørsforhold på den tropiske vestlige halvkugle er svækket i de seneste årtier
- Hvorfor Silicon Valley venturekapitalfirmaer finansierer onlineforhandlere som Dollar Shave Club
- Oversvømmelser dræber 37 i Indiens turisthotspot Kerala
- Sådan beregnes sandsynligheden for en Punnett Square
- Jupiters magnetfelt kan bevæge Europas ocean
- Opfattet hvidhed hos mellemøstamerikanere korrelerer med diskrimination


